1.2.- Propiedades Termodinámicas
Las propiedades termodinámicas son el calor (q), el trabajo (w) y la energía interna (E).
CALOR (q) Unidades: J, kJ, cal | El calor en termodinámica se considera como la energía que fluye al entrar en contacto 2 sustancias que se encuentran a diferente temperatura. El calor siempre fluye del cuerpo caliente al cuerpo frío. Por convención el calor que sale de un sistema tiene signo negativo; mientras que el calor que ingresa a un sistema tiene signo positivo. El calor no es Función de Estado, depende del camino recorrido. |
TRABAJO (w) Unidades: J, kJ, cal | El trabajo en termodinámica siempre representa un intercambio de energía entre un sistema y su entorno.
Por convención el trabajo que realiza el entorno sobre el sistema tiene signo positivo; mientras que si el sistema el que realiza trabajo sobre el entorno tiene signo negativo. El trabajo no es Función de estado, depende del camino recorrido. |
ENERGÍA INTERNA (E) Unidades: J, kJ,cal | La Energía interna, es la suma de todas las energías existentes en el sistema (cinética, térmica, potencial, etc). Algunos autores la representan con la letra U No se puede determinar, en forma absoluta, por lo tanto lo que se mide es la variación de energía interna del sistema (Delta de E). Es propiedad extensiva, dependerá de la cantidad y calidad de materia. La Energía Interna es función de estado, no depende del camino recorrido. |
Postulados Termodinámicos
- Las propiedades de un sistema en equilibrio termodinámico, son funciones de estado.
- El contenido de energía es una función puntual del estado del sistema. (una cantidad fija de materia no tiene la misma energía asociada a otra condición)
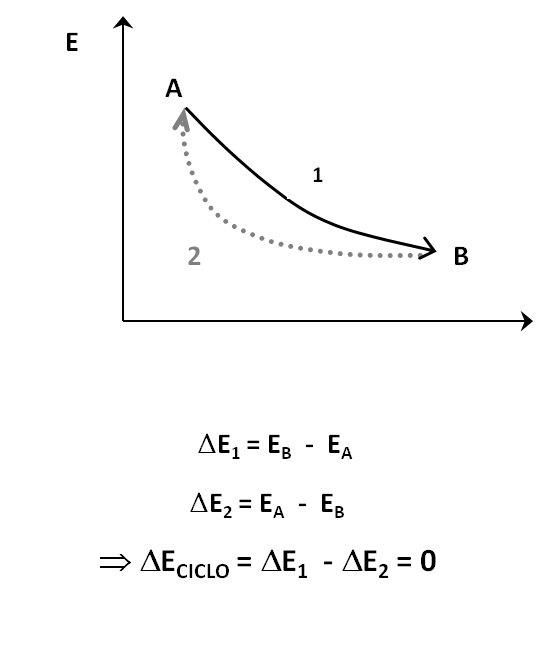
- En cualquier ciclo termodinámico por el cual el sistema es restaurado a su estado inicial, la suma algebraica de los intercambios de energía con los sistemas limitantes es cero.
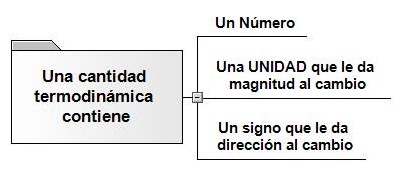
Cantidad Termodinámica
 |
A + B ? C + D Estado Inicial Estado Final |
Unidades de la energía en el Sistema Internacional (SI)
La unidad derivada de energía en el SI es el Joule.
1 Joule (J) = 1 kg m2/s2 = 1 N m
por lo general emplearemos 1 kJ que equivale a 103 J.
Otras unidades de uso frecuente y sus equivalencias
1 Caloría = 4,184 J
1 electrón – voltio (eV) = 1,602 x 10-19 J
1 L atm = 101,325 J
1 unidad térmica británica (Btu) = 1055 J

