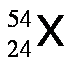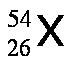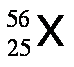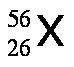1.3. Estructura del Átomo
Desde epocas muy remotas existe el interés por conocer la naturaleza de la materia, podemos encontrar más información al respecto en http://www.visionlearning.com/library/module_viewer.php?mid=50&l=s o al ver el siguiente video:
La primera teoria con base científica, sobre el átomo es la Teoría de Dalton, cuyos postulados fueron reveladores para su época (1808):
- La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
- Los átomos de un mismo elemento son iguales entre sí, tienen su propio peso y cualidades propias. Los átomos de los diferentes elementos tienen pesos diferentes.
- Los átomos permanecen sin división, aún cuando se combinen en las reacciones químicas.
- Los átomos, al combinarse para formar compuestos guardan relaciones simples.
- Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
- Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos.
La hipótesis de Dalton, tuvo vigencia durante mucho tiempo, en la que se afirmaba que el átomo era indivisible; sin embargo, los átomos permanecen indivisibles en los fenómenos químicos simples.
En base a la teoría de Dalton se pudo establecer que:
El átomo es la parte más pequeña en que se puede dividir una molécula.
La molécula es la parte más pequeña en que se puede dividir la materia, sin cambiar sus propiedades naturales.
Investigaciones realizadas poseriormente al trabajo de Dalton, llegaron a lo que conocemos actualmente:
- El átomo tiene una estructura interna que está formada por partículas aún más pequeñas, llamadas partículas subatómicas: electrones, protones y neutrones.
- Los protones y los neutrones se encuentran en el interior del núcleo y los electrones fuera de él.
Las características principales de estas partículas subatómicas son:
| partícula | símbolo | masa (g) | carga (Coulomb) | carga |
|---|---|---|---|---|
| electrón | e- | 9,1094 x 10-28 | - 1,6 x 10-19 | - 1 |
| protón | p | 1,6726 x 10-24 | + 1,6 x 10-19 | + 1 |
| neutrón | n | 1,6749 x 10-24 | 0,00 | 0 |
Estudios posteriores han determinados la existencia de otras partículas subatómicas, tal como se puede observar en el siguiente video:
Número de masa, A: está dado por el número total de protones y neutrones presentes en el núcleo del átomo de un determinado elemento.
A fin de dar mayor énfasis y claridad se suele escribir el número atómico como un subíndice a la izquierda del símbolo del elemento y el número de masa como superíndice a la izquierda del símbolo del elemento, tal como se muestra a continuación:

 |
Ejercicio 1.3 El potasio, K, (Z = 19), es un mineral que se encuentra en muchos alimentos diferentes, ayuda a mantener la presión arterial normal y también ayuda a que los músculos, incluyendo el corazón, se contraigan apropiadamente. a) Determina cuántos protones, electrones y neutrones están presentes en un átomo de potasio-41. b) Escribe su símbolo atómico incluyendo su número de masa y número atómico. |
Los isótopos son aquellos átomos que poseen el mismo número atómico, Z, pero tienen diferente número de masa, A. Por ejemplo, existen tres isótopos del hidrógeno, tal como se muestra a continuación:

Para especificar a cuál de los isótopos nos estamos refiriendo, se escribe el número de masa después del nombre o del símbolo del elemento, por ejemplo carbono-12 o C-12. Una muestra de átomos de hidrógeno de existencia natural está conformada por 99,985 % de H-1 y 0,015 % de H-2, ya que el H-3 no existe de forma natural. Las propiedades químicas de los isótopos de cualquier elemento son prácticamente indistinguibles.
 |
Ejercicio 1.4 a) Identifica el o los pares de isótopos entre los átomos dados en la siguiente lista:
b) Revisa la tabla periódica e identifica el o los elementos que tienen estos isótopos. |
 |
Importante: En un átomo neutro se cumple que: # p = # e- entonces Z también nos informa sobre el # e-. |
 |
Actividad 1.1 Ingresa al link dado a continuación, donde podrás encontrar, en la primera pestaña, información sobre la historia de los modelos atómicos; luego en la segunda puedes resolver las preguntas planteadas; en la tercera podrás "construir" átomos y por último en la cuarta pestaña, encontrarás un modelo interactivo sobre la estructura electrónica y algunos ejercicios, que te serán útiles una vez estudiada la segunda unidad: |