1.3.2.- Primera Ley de la Termodinámica: Procesos Isotérmicos y Procesos Isobáricos.
Proceso Isotérmico
Recordemos que en un proceso isotérmico, la temperatura se mantiene constante.
La energía interna depende de la temperatura. Por lo tanto, si un gas ideal es sometido a un proceso isotérmico, la variación de energía interna es igual a cero.
Por lo tanto, la expresión de la 1ª Ley de la Termodinámica
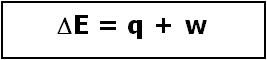
se convierte en: q = - w
De tal manera que en un proceso isotérmico el calor entregado al sistema es igual al trabajo realizado por el sistema hacia los alrededores.
Gráficamente el w se puede hallar calculando el área bajo la curva del diagrama P-V.

Observen que el trabajo es el área bajo la curva (isoterma)
Proceso Isobárico
Recordemos que en un proceso isobárico, la presión permanece constante.
La mayoría de los cambios físicos y químicos ocurren a presión constante.
Por ejemplo, una reacción química, que se realiza en un sistema abierto, la presión es la presión atmosférica y ésta no varía durante el proceso.
Como hemos visto a presión constante:
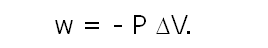
El calor involucrado en el proceso a P = cte. se denota como qP.
Aplicando la primera ley: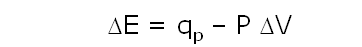
reordenando la expresión, podemos llegar a:
qP = (E2 + PV2) – (E1 + PV1)
Los químicos denominan Entalpía (H) al calor de un sistema a presión constante,
Siendo la Entalpía:
- Propiedad extensiva y
- Función de estado.
Entonces, en un proceso isobárico la expresión de la Primera Ley de la Termodinámica
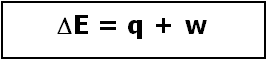
se puede expresar también como:

El proceso isobárico, en un diagrama PV:
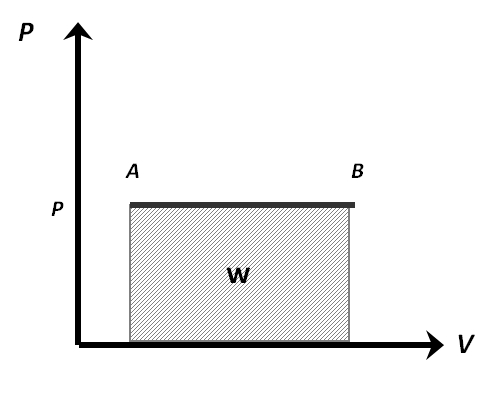
Se puede calcular el trabajo de manera gráfica, ya que él es área bajo la curva. Tengan en cuenta que, si se calcula de manera gráfica, las unidades del trabajo, estarían en atm-L. Normalmente se debe hacer un cambio de unidades a Joule o calorías.
