1.4. Masa atómica - concepto de mol - masa molar
El número de partículas subatomicas (protones, neutrones y electrones) presentes en el átomo, determinan la masa del mismo. Por lo tanto, conociendo la masa de las partículas subatómicas, podemos determinar la masa de un átomo cualquiera, como por ejemplo, en el caso del átomo de nitrógeno,  :
:
Masa del átomo de nitrógeno = 7 p x masa protón + 7 n x masa neutrón + 7 e- x masa electrón
= 7 p (1,673x10-24 g/p) + 7 n (1,675x10-24 g/n) + 7 e- (9,109x10-28 g/e-)
= 2,344x10-23 g
Como podemos observar, la masa de cada átomo es sumamente pequeña, por lo que resulta imposible trabajar con un sólo átomo de cualquier elemento. Sin embargo, para trabajar en cualquier experimento en el laboratorio, es necesario el conocer la masa, por ello se estableció el sistema de masa referencial, es decir, establecer las masas de los elementos en función de la masa de otro.
 |
Importante: Para elegir apropiadamente el patrón de referencia, se debe tener en cuenta que sea el más abundante. Mediante convenio internacional se estableció que el átomo de referencia sería el carbono-12, por ser el más abundante en la naturaleza, asignándole una masa relativa de 12 uma (unidades de masa atómica). La unidad de masa atómica, uma, se define como la masa exactamente igual a la doceava (1/12) parte de la masa de un átomo de carbono-12. |
Masa atómica promedio
La mayor parte de los elementos se presentan en la naturaleza como una mezcla de isótopos con diferentes abundancias relativas, por ello conociéndolas, se puede determinar la masa atómica promedio del elemento, así por ejemplo:
 |
Problema 1.1 El silicio, que representa el 25 % de la masa de la corteza terrestre, está constituido por una mezcla de tres isótopos naturales según se muestra en la siguiente tabla: |
| Isótopo | Masa (uma) | abundancia relativa (%) |
|---|---|---|
| 28Si | 27,976927 | 92,23 |
| 29Si | 28,976495 | 4,67 |
| 30Si | 29,973770 | 3,10 |
Para determinar la masa atómica promedio se debe tener en cuenta el aporte en masa de cada isótopo según su abundancia relativa:


masa atómica promedio = 28,085509 uma
Concepto de mol
 |
Ejercicio 1.5 ¿Cuántos lápices hay en una docena de lápices? ¿Cuántas monedas de 5 soles habrá en un millar de monedas de 5 soles? ¿Cuántos IPod hay en una caja que contiene 3 cientos de Ipod? ¿Cuántas mini memory cards hay en una caja que contiene una gruesa* de mini memory cards? (*Revisa la definición N° 10 en http://buscon.rae.es/draeI/SrvltConsulta?TIPO_BUS=3&LEMA=gruesa)
|
Existen otros términos como docena, millar, ciento, gruesa, etc., que nos informan sobre la cantidad de objetos a los que nos referimos y que elegimos según el número de ellos. Como hemos visto, los átomos son partículas sumamente pequeñas y en los objetos que los contienen hay muchísimos de ellos, por ejemplo la partícula de polvo más pequeña que podemos observar a simple vista contiene alrededor de 1x1016 átomos, por lo tanto, para poder referirnos a determinada cantidad de ellos, así como de otros "objetos" microscópicos, necesitamos hacer uso de una unidad científica estándar, que se denomina "mol" y que representa a 6,023x1023 "objetos".
 |
Importante En el sistema internacional de unidades, SI, el mol es la cantidad de una sustancia que contiene tantas entidades elementales (átomos, moléculas u otras partículas), como átomos hay exactamente en 12 gramos del isótopo de carbono-12. En otras palabras: un mol es el número de átomos de 12C que hay en 12 g de dicho isótopo. |
El número real de átomos de C-12 que se encuentran en 12 g de 12C se denomina el número de Avogrado, NA, en honor al científico italiano Amadeus Avogadro; es decir, el número de objetos presentes en un mol:
NA = 6,022 x 1023
 |
Observación La masa de un mol de átomos de 12C tiene el valor de 12 g, numéricamente igual al de la masa de un átomo de 12C que es de 12 uma, en consecuencia:
|
En consecuencia, si la masa de un átomo de hierro, Fe, tiene el valor de 55,85 uma, podemos afirmar que la masa de un mol de átomos de hierro es de 55,85 g, es decir:
55,85 uma ⇔ 1 átomo de Fe
55, 85 g ⇔ 1 mol de átomos de Fe
De donde podemos escribir:
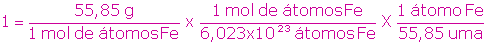
Y podemos obtener las siguientes equivalencias:
1 g = 6,022x1023 uma
1 uma = 1,661x10-24 g
 |
Problema 1.2 En base a lo estudiado hasta el momento, podemos aplicar el concepto de mol a la cantidad de partículas presentes en los átomos, por ejemplo, para el átomo de |
cantidad de  |
# p | # n | # e- |
|---|---|---|---|
| 1 átomo | 7 | 7 | 7 |
| 1 mol de átomos | 7 moles | 7 moles | 7 moles |
| 6,022 x 1023 átomos | 4,2154 x 1024 | 4,2154 x 1024 | 4,2154 x 1024 |
 |
Problema 1.3 Tal como trabajamos con otras unidades de cantidad, también podemos trabajar con fracciones y múltiplos de mol, así por ejemplo, si tenemos 45 g de silicio, Si, podemos determinar cuántas moles de Si (moles de átomos de Si) tenemos: Anteriormente determinamos que la masa atómica promedio del Si es 28,055 uma, es decir, la masa de 1 mol de átomos de Si será de 28,055 g, en consecuencia:
|
 |
Ejercicio 1.6 En una caja de gelatina se observa la siguiente leyenda: Composición por cada porción de 5,67 g: Calcio: 1,7 g; Sodio: 55 mg y Vitamina C: 12 mg En base a esta información determina para el calcio, Ca, (masa atómica = 40 uma):
|
|
¿El origen del término "mol"? El término "mol" no fue acuñado por Avogadro pero su trabajo originó la unidad que denominamos "mol". Probablemente el primero en usarlo haya sido Wilhelm Ostwald alrededor de 1900. Es posible que la palabra derive del latin "molus" que significa "pila pequeña". Otra fuente indica que el término "mol" puede provenir del alemán "molekulargewicht". Algunos han sugerido que proviene del fraccionamiento de la palabra "molécula"; sin embargo, no se conoce el origen real. Adaptado y tomado de http://www.moleday.org |
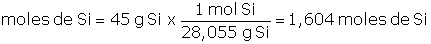
 .
.