1.4.3.- Cálculo del Calor de Reacción: Ley de Hess
La Ley de Hess, es un método indirecto de calcular el Calor de Reacción ó Entalpia de Reacción.
La ley de Hess se puede enunciar como sigue:cuando los reactivos se convierten a productos, el cambio de entalpía es el mismo, independientemente de que la reacción se efectúe en una paso o en una serie de pasos.
En el ejemplo siguiente veremos la aplicación de la Ley de Hess.
Se quiere calcular la Entapía de reacción para la reacción:
2 C(s) + H2(g) → C2H2(g)
Nos proporcionan los datos siguientes:

Planteamos las ecuaciones correspondientes a las entalpías dadas:
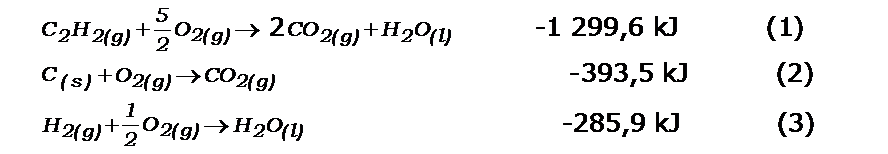
Ubicamos en ellas a los reactantes y productos de la reacción química que buscamos:
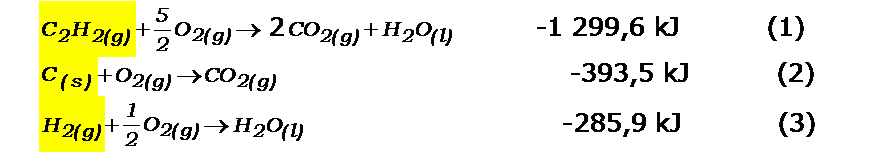
Ahora debemos acomodar las ecuaciones:
- la ecuación (1) la debemos invertir (recuerden que también se invierte el valor de la entalpía)
- la ecuación (2), debemos multiplicarla por 2 (recuerden se multiplica toda la ecuación, tanto reactantes como productos y el valor de la entalpía, pues es propiedad extensiva.
- la ecuación (3), la dejamos igual.
La sumatoria de las ecuaciones acomodadas debe darnos la ecuación problema.
- Se suman o se anulan los reactantes y productos.
- Las entalpías se suman algebraicamente.

Basandonos en la Ley de Hess, hemos podido encontrar el:
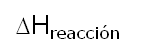
La Ley de Hess basa su principio en que la variación de la entalpía es una función de estado.
Por lo tanto,
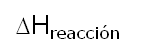
es independiente del número de pasos y de la naturaleza específica de cada uno de ellos.
 |
Problema |
|
Jorge ha encontrado en Internet que se puede producir gas etano, C2H6, a partir de hidrógeno gaseoso, H2, y monóxido de carbono, CO, con producción adicional de gas oxígeno O2. Aplicando la Ley de Hess, encuentra el calor de reacción para la producción de etano. Emplea para ello las reacciones que se te dan a continuación:
Señala además si ¿la reacción propuesta en Internet será endotérmica o exotérmica? |
Calor de Disolución y de Dilución
Hasta ahora hemos centrado el cálculo del calor de reacción como producto de las reacciones químicas, pero muchos proceso físicos, como la fusión del hielo o la condensación de un vapor, también implican la abosrción o desprendiemiento de calor.
También hay cambios de entalpía cuando un soluto se disuleve en un disolvente, o cuando se diluye una disolución.
Veremos ahora estos dos procesos físicos relacionados, que implican al calor de disolución y al calor de dilución.
Para ello debemos definir primero algunos conceptos, entre ellos la Energía Reticular.
Energía Reticular
La formación de compuestos iónicos depende de los valores de las energías de ionización y de la afinidad electrónica de los elementos, estos valores ayudan a predecir cuáles elementos son los más adecuados para formar compuestos iónicos, pero, ¿cómo se puede evaluar la estabilidad de un compuesto iónico? Tanto la energía de ionización, como la afinidad electrónica están definidas por procesos que se llevan a cabo en la fase gaseosa. A 1 atmósfera y 25ºC todos los compuestos iónicos son sólidos.
Una medida de la estabilidad de cualquier sólido iónico es su energía reticular, U, que se define como la energía requerida para separar completamente un mol de un compuesto iónico sólido en sus iones al estado gaseoso.
NaCl(s) → Na+(g) + Cl- (g)
Los valores de Energía reticular (U) serán siempre positivos, pues es la energía suministrada para que se produzcan la disociación del compuesto ionico.
La energía reticular no se puede medir directamente, pero se puede calcular de manera indirecta, si se considera que la formación de un compuesto iónico se efectúa en una serie de pasos conocidos como ciclo de Born -Haber. El ciclo de Born-Haber relaciona las energías de ionización, afinidad electrónica, calor de sublimación, energías de enlace y otras propiedades atómicas y moleculares.
Si queremos encontrar la energía reticular del compuesto iónico LiF(s), y disponemos de los datos siguientes:
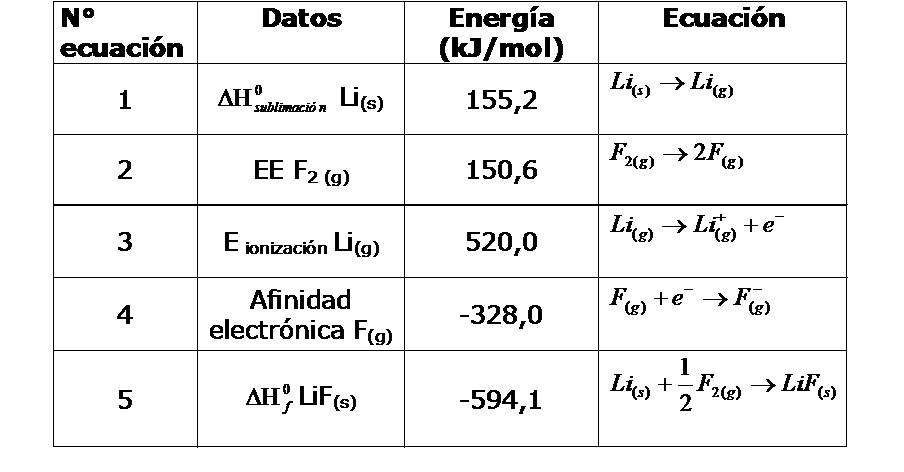
Debemos:
1. Plantear la ecuación problema.
LiF(s) → Li+(g) + F-(g)
2. Localizar reactantes y productos de nuestra ecuación problema en las ecuaciones dadas.
- Reactantes en la (5)
- Productos en la (3) y (4)
3. Analizar todas las demás ecuaciones, ubicar cuál o cuáles debemos tomar directamente y cuál o cuáles de forma inversa y si alguna necesita multiplicarse por un factor, de tal manera que al aplicar la ley de Hess, se obtenga la ecuación problema.
4. Recordar que la entalpía es una propiedad extensiva, por lo tanto, si se considera una reacción inversa, la energía debe cambiar de signo, y si se multiplica por algún factor, también afectará el valor de la energía.
5. Tomando en cuenta las consideraciones anteriores al aplicar la ley de Hess, tendremos lo siguiente:
- La ecuación 5 se tomará de forma inversa;
- Las ecuaciones 3, 4 y 1 se tomaran de forma directa; y
- La ecuación 2 deberá multiplicarse por ½
De tal manera que:
Energía Reticular:
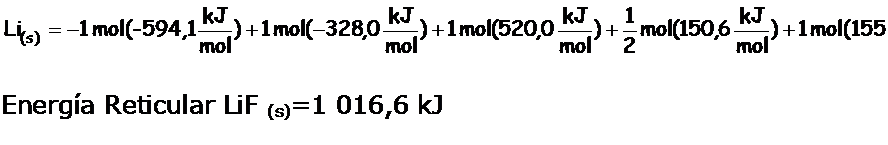
Tal como ya hemos mencionado los valores de energía reticular siempre serán positivos, dado que debemos proporcionar energía al sistema.
Sus valores nos proporcionan una información sobre la estabilidad del enlace, tal como se puede apreciar en la tabla anexa sobre valores de energía reticular vs. puntos de fusión.
Algunos Valores de Energía Reticular en kJ/mol y Punto de Fusión en °C
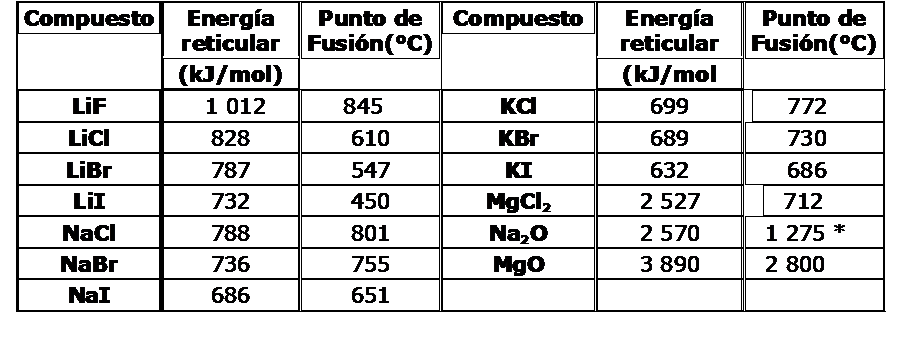
* Sublima
 |
Explica la diferencia de puntos de fusión para los siguientes pares de compuestos iónicos:
|
Calor de Disolución
Debemos recordar que por proceso de disolución entendemos cuando un soluto se disuelve en un disolvente, formándose una solución homogénea, siempre y cuando todo el soluto se disuelva en el disolvente. El calor de disolución ó entalpía de disolución es el calor generado o absorbido cuando cierta cantidad de soluto se disuelve en cierta cantidad de solvente.
Por ejemplo, si el solvente es agua, la ecuación termoquímica correspondiente al proceso de disolución de un soluto X(s) en “n” moles de agua, será:
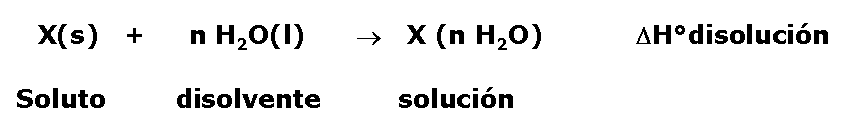
donde n, es el número de moles de agua que se emplean en la disolución.
Para poder entender este proceso, podemos pensar en la sal de mesa, nosotros decimos cuando esta no cae facilmente del salero, que la sal está húmeda, esto significa que tiene incorporada algunas moleculas de agua, pero no son suficientes para formar aun una disolución.
Realmente la disolución de una sal iónica es un proceso que involucra varios pasos que se suceden de forma muy rápida, nosotros solo podemos apreciar el efecto final, que es la formación de la solución homogénea de la sal en agua.
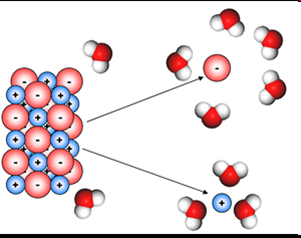
http://ocw.uc3m.es/ciencia-e-oin/quimica-de-los-materiales/Material%20de%20clase/tema5d.htm
Si observamos la figura correspondiente al proceso de disolución: en un primer plano podemos ver la red cristalina del cloruro de sodio y a su alrededor las moléculas de agua,. En la etapa final (a la derecha, superior), cada ion (Na+ y Cl-) rodeado o solvatado por las moléculas de agua. Este paso involucra el Calor de Disolución.
Nosotros solo podemos observar el resultado de la disolución, pero en realidad este proceso ocurre en dos etapas:
Primero ocurre la separación de la sal iónica, (Energía Reticular) , luego que los iones se separan, recién el agua actúa rodeando a cada uno de los iones, la energía necesaria para este proceso se conoce como Calor de Hidratación, que nos conduce finalmente a la disolución de la sal en agua.
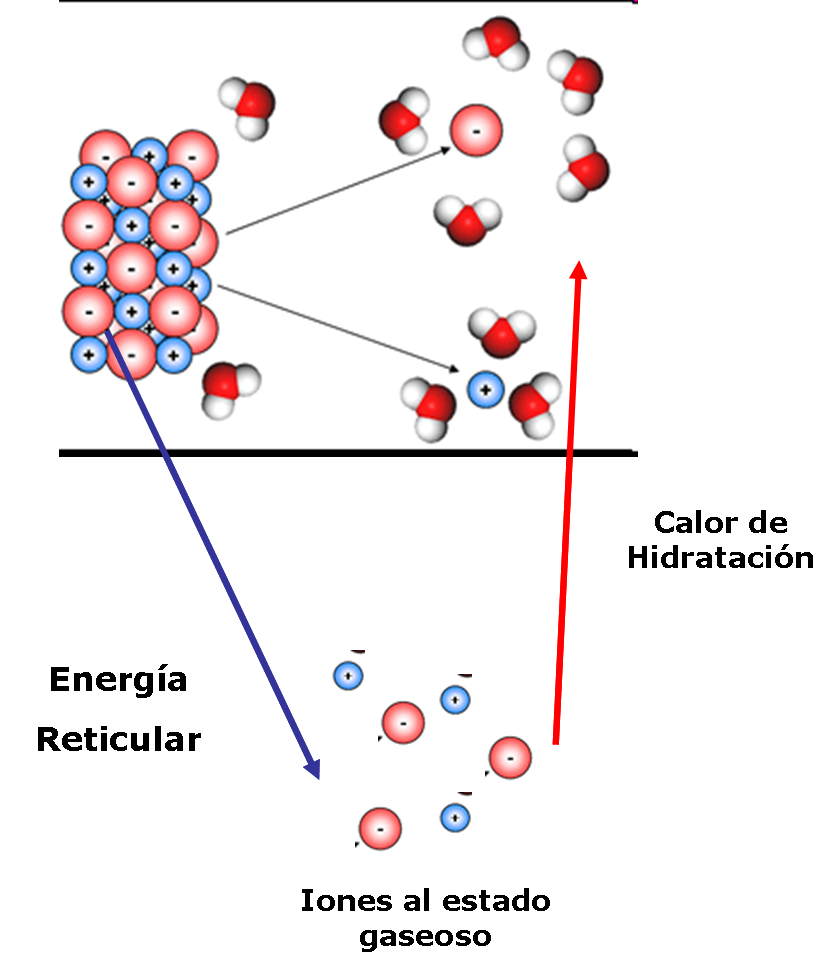
El agua actúa como un separador de los iones y al alejarse uno del otro la fuerza electrostática disminuye considerablemente hasta anularse, dando paso a la disolución.
Se puede apreciar que el:

Calor de Dilución
Debemos recordar que el proceso de dilución ocurre cuando a una solución formada se le agrega mayor cantidad de disolvente. Ejemplo, tenemos una taza con café y para nuestro gusto está muy "cargado" (concentrado), lo que hacemos será agregarle más agua para que la concentración disminuya, éste será un Proceso de dilución.
Cuando se diluye una disolución preparada previamente, es decir, cuando se le adiciona más disolvente para disminuir la concentración total del soluto, por lo general se libera o se absorbe calor adicional.
El Calor de Dilución es el cambio de calor asociado al proceso de dilución.
La ecuación termoquímica correspondiente a una dilución acuosa será:
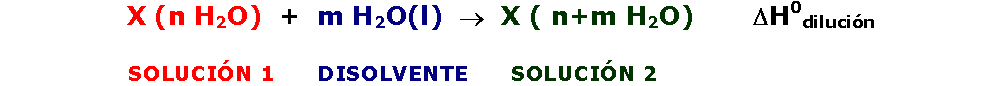
El calor de dilución se puede calcular como:

Pensemos en que se realiza una disolución de una sal en el laboratorio, la preparación de esta solución o disolución requiere o genera una cantidad de calor; si aregamos más disolvente a la solución preparada, ésta dilución puede requerir mas energía o liberar energía.
Entonces:
- Si cierto proceso de disolución es endotérmico y la solución se diluye posteriormente, la misma disolución absorbe más calor de los alrededores.
- Lo contrario ocurre en un proceso exotérmico de disolución: se libera más calor si se agrega más disolvente para diluir la disolución
Por lo tanto, se debe tener cuidado al trabajar con procesos de disolución en el laboratorio.
Por ejemplo, en el ácido sulfúrico concentrado (H2SO4), el calor de dilución es altamente exotérmico. En consecuencia, es peligroso disminuir su concentración agregándole agua. El ácido sulfúrico concentrado (H2SO4) está formado por 98% en masa de ácido y 2% en masa de agua. Al diluirlo con agua se libera una gran cantidad de calor hacia los alrededores. Este proceso es tan exotérmico que jamás se debe intentar diluir la concentración del ácido agregándole agua. El calor que se genera puede hacer que la disolución del ácido hierva y se proyecte fuera del recipiente, el proceso que se recomienda seguir es agregar poco a poco el ácido concentrado al agua (al tiempo que se agita constantemente).
 |
El calor estándar de vaporización, fusión, sublimación de cualquier sustancia, es la energía térmica requerida para vaporizar, fundir, sublimar, un líquido (sólido) en su punto de ebullición (fusión, sublimación)
|

