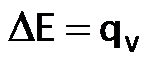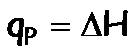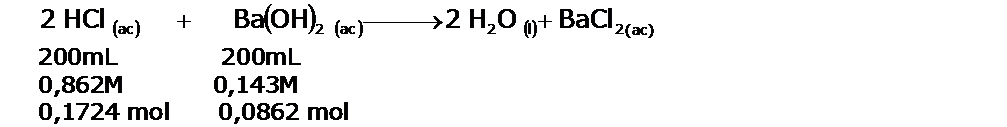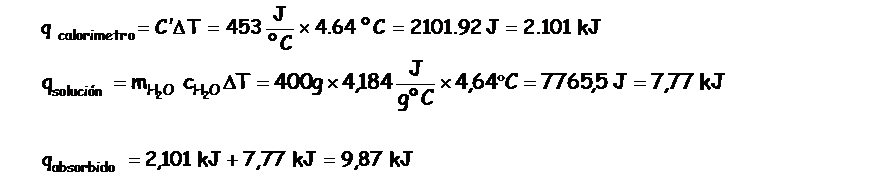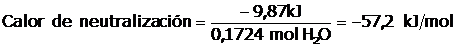1.4.4.-Cálculo de calor de reacción: Calorimetría
El estudio de la Calorimetría, comprende la medición de los cambios de calor, producido en los procesos físicos y químicos. El equipo que se emplea en un laboratorio para realizar estas mediciones se llama calorímetro. Recuerden que una manera de medir el calor es la temperatura.
Para comprender como se puede medir la cantidad de calor analizaremos dos situaciones:
 |
Las compresas frías son bastante empleadas para aliviar dolores musculares. Ahora analicemos que ha ocurrido, desde el punto de vista termodinámico:
La compresa ganó calor y que este calor fue cedido por la pierna del paciente. |
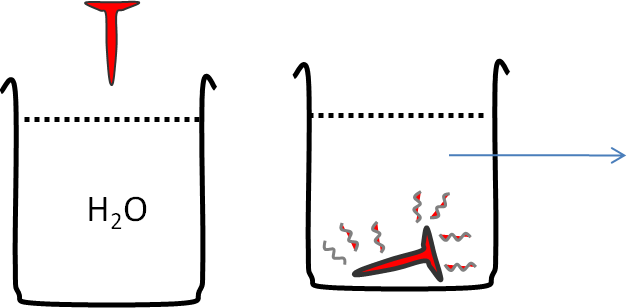 |
Si un clavo de hierro lo pones al fuego, hasta que se encuentra al “rojo vivo” (alta temperatura), y lo introduces en un vaso con agua a temperatura ambiente. Tu experiencia te dice que el agua se calentará. Si analizamos la situación desde el punto de vista termodinámico, podemos pensar que:
|
|
Si para realizar el experimento del clavo empleamos un calorímetro. Teniendo en cuenta que un calorímetro es un recipiente adiabático (sistema aislado, que no permite la entrada ni salida de calor), en donde el q=0, podremos concluir: -q liberado = q absorbido Lo que es lo mismo que pensar que: q liberado + q absorbido =0 |
|
El calor de una reacción se mide en un calorímetro, recipiente adiabático en donde se determina el calor absorbido o desprendido durante la reacción. Hay dos clases de calorímetros, cada uno de ellos emplea un proceso diferente y han sido diseñados para situaciones diferentes también.
- Calorímetro a presión constante: mide el calor a presión constante, por lo tanto determina directamente la variación de la Entalpía:
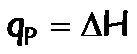
- Calorímetro a volumen constante, llamado también bomba calorimétrica: mide el calor a volumen constante, por lo tanto determina directamente la la variación de la energía interna:
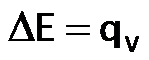
Calorímetria a Volumen Constante
En la figura que se da a continuación se muestra el esquema de una bomba caloimétrica (calorímetro a volumen constante)
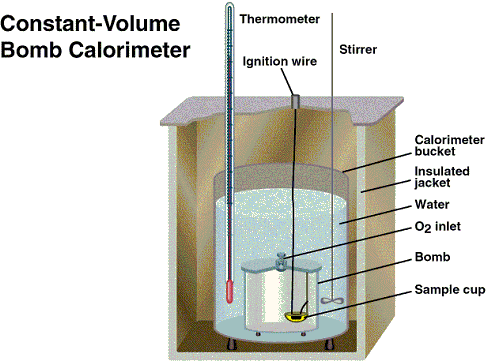
 |
En el enlace siguiente puedes ver el montaje de una bomba calorimétrica http://www.slideshare.net/guesta62a6f/bomba-calorimetrica-presentation |
Si queremos determinar el calor de reacción de la combustión de una muestra, colocamos la muestra en una bomba calorimetrica.
Debemos conocer:
- el peso de la muestra analizada, recordemos que el calor es una propiedad extensiva.
- el volumen de agua que se colocará en el interior de la bomba calorimétrica.
- la temperatura del agua antes de inciar la reacción de combustión.
- la bomba debe cerrarse, recuerden que es un sistema adiabático.
- luego de ello, haciendo uso de unos dispositivos electricos se genera la chispa que provocará la combustión de la muestra.
- Lo que ocurrira en el interior de la bomba, lo podemos ver en el esquema siguiente:
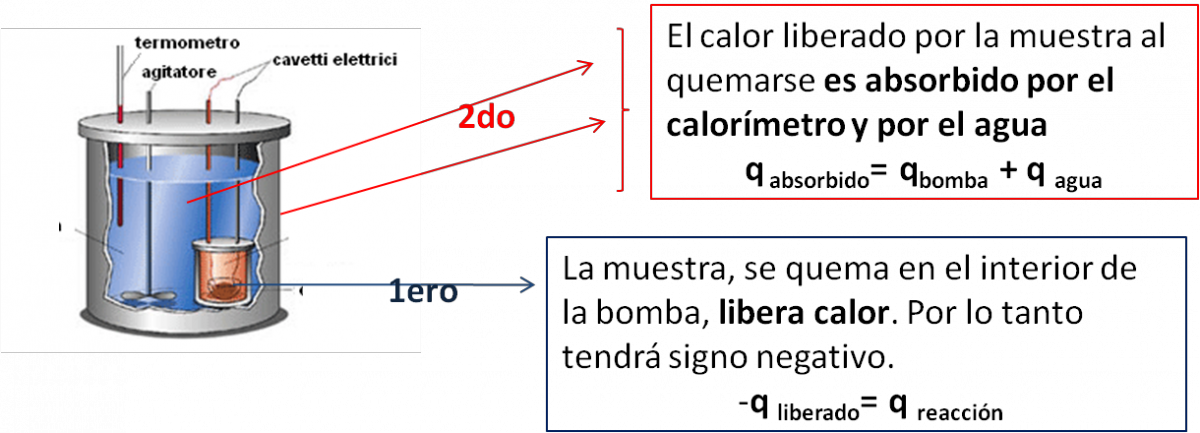

Ahora debemos calcular la cantidad de calor abosrbido por el agua y por la bomba calorimetrica, con estos dos datos podemos calcular el calor de la reacción de combustión.
Teniendo en cuenta la cantidad de agua que contiene el calorímetro, por lo general está cantidad es constante para cada equipo.
Cálculo de la cantidad de calor absorbido por el agua:

Para poder calcular el calor absorbido por la bomba calorímetrica, necesitamos conocer:
- la masa de la bomba, y
- el calor específico del material con el que está fabrica. En muchos casos como el masa de la bomba es constante el fabricante proporciona la capacidad calorífica
Cálculo de la cantidad de calor absorbido por la bomba calorimétrica :

Si se conoce, la capacidad calorífica del material de la bomba (la masa de la bomba y el calor específico del material del que está hecha, permanecen constantes), podemos decir:
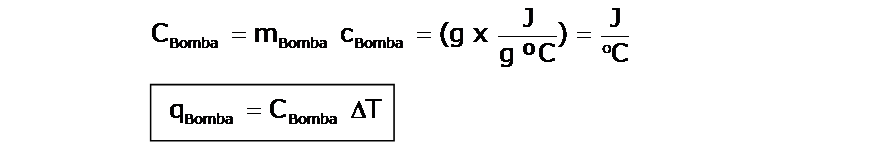
Conociendo el calor absorbido por el agua y por la bomba, podemos determinar el calor liberado por la reacción, que en el ejemplo es de combustión. Tengan en cuenta que el calor determinado es respecto a la muestra que se ha quemado. Por ejemplo, si colocamos 1,5 g de una sustancia y determinamos el calor de combustión, este será el calor liberado por 1,5 g de la sustancia en cuestión.
Cuando se trabaja siempre con la misma bomba calorímetrica:
- la masa de agua y de la bomba son constantes.
- el calor específico del agua y del material tambien son constantes.
|
|
Recuerden que en una bomba calorímetrica se mide el calor a volumen constante. Por lo tanto:
|
|
En un proceso isóbarico la variación de la energí intena se expresa: Si el sistema lo forman gases ideales, PV= nRT Lo que nos lleva a: |
|
 |
Problema En una bomba calorimétrica a volumen constante se quema 1,435 g de naftaleno (C10H8), un sólido de olor penetrante, repelente de las polillas, conocido por nosotros como naftalina. Como consecuencia de la combustión del naftaleno, la temperatura en el interior de la bomba calorimétrica, se eleva de 20,17ºC hasta 25,84ºC.
|
| Pasos a seguir: | |
|
|
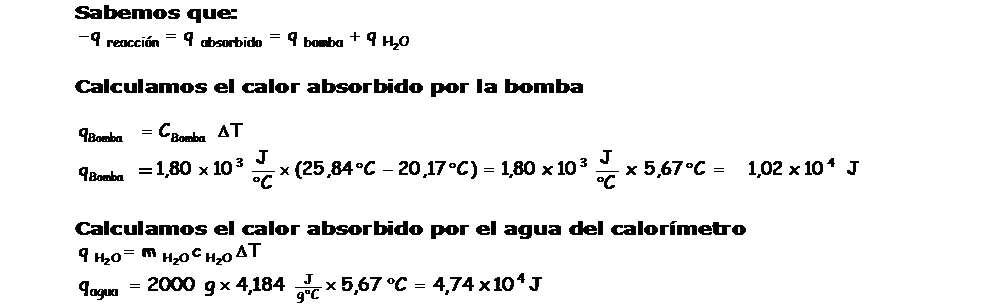 |
|
 |
|
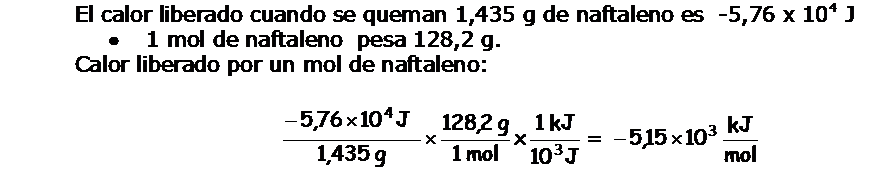 |
|
 |
|
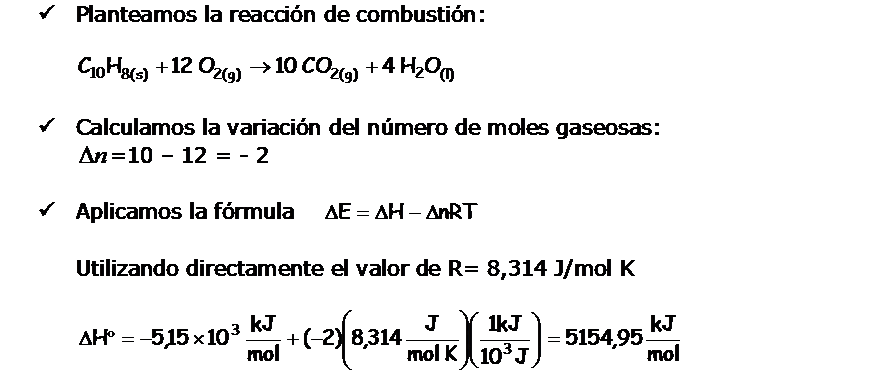 |
Calorimetría a Presión Constante
Los calorímetros a preseión constante son dispositivos mucho más sencillos que las bombas calorímetricas. De manera muy sencilla un calorímetro a presión constante se puede construir con dos vasos descartables, o con un termo, como lo muestra la diagrama siguiente. Lo importante es que el dispositivo empleado sea adiabático.
Se utiliza para medir el calor de reacción cuando los reactantes y productos no se encuentran en estado gaseoso.
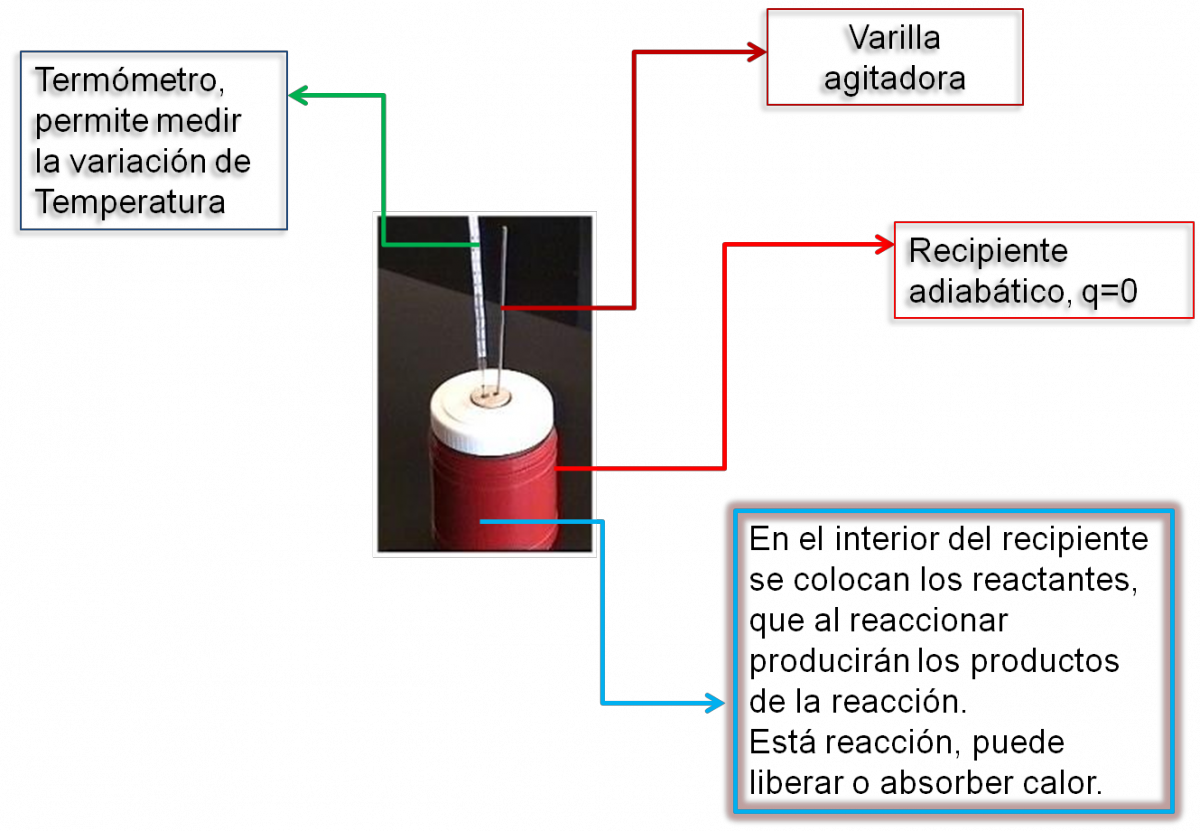
Estos dispositivos permiten medir el calor de reacción de una gran cantidad de reacciones, entre ellas:
- neutralizaciones ácido-base
- calor de disolución
- calor de dilución
 |
Para determinar el calor de reacción en un calorimetro a presión constante debemos tener las siguientes consideraciones:
|
|
Cuando determinamos el calor de reacción en un calorímetro a presión constante, medimos directamente la variación de la entalpía
|
Calor de Neutralización
![]()
Una reacción de neutralización, es aquella que se da entre un ácido y una base, esta reacción produce
una sal y H2O.
El calor de neutralización se define como el calor liberado por cada mol de agua formada como producto de la reacción.
Por lo tanto será necesario que:
- conozcamos la estequiometría de la reacción de neutralización
- determinemos el reactivo limitante de la reacción
- determinemos el numero de moles de agua que se formarán en la reacción de neutralización.
 |
Ejercicio |
|
En un calorímetro a presión constante, se hacen reaccionar 200 mL de ácido clorhídrico, HCl de una concetración 0,862 M y 200 mL de hidróxido de bario, Ba(OH)2 de una concentración 0,431 M. Luego de la neutralización la temperatura se elevó en 4,64°C. La capacidad calorífica del calorímetro es 453 J/°C. Calculen:
Procedimiento: |
|
|
Planteamos la reacción de neutralización, para averiguar el número de moles de H2O que se producen en ella:
El reactivo limitante será el HCl, por lo tanto se producirán 0,1724 moles de agua. Esto es importante, pues el calor de neutralización es el calor liberado por cada mol de agua producida. Luego el calor medido, será el producido por 0,1724 mol de H2O. Luego realizamos los calculos corresponidentes al experimento:
q absorbido= q solución + q calorímetro
Como se trata de un sitema adiabático tendremos que: - q liberado= q absorbido Luego tendremos que el q liberado = - 9,87 kJ Recuerden que está cantidad de calor liberado corresponde a 0,1724 moles de agua, para calcular el calor de neutralización debemos de averiguar el calor liberado por un mol de agua producido, luego:
Lo que significa que por cada mol de agua producida en la neutralización se liberan 57,2 kJ/mol |
|
 |
Si tenemos que calcular el calor de reacción y disponemos de:
El valor mas exacto será el experimental. El valor más aproximado será el encontardo con Energía de Enlace. |