1.5.- Segunda Ley de la Termodinámica
La primera Ley de la Termodinámica nos ha permitido entender que la energía puede interconvertirse de una forma en otra, pero no puede crearse o destruirse. En otras palabras, que la energía se puede transferir entre el sistema y sus alrededores o se puede convertir en otra forma de energía, pero la energía total permanece constante.
La primera ley nos ayuda a hacer el balance, por así decirlo, respecto al calor liberado o absorbido, al trabajo efectuado o recibido, en un proceso o reacción en particular, pero, no podemos emplear este argumento para saber si un proceso sucede o no.
La segunda Ley de la termodinámica nos explica por qué los procesos químicos suceden de manera espontánea.
Los procesos espontáneos y la Entropía
La Flecha del tiempo
Si alguién proyectará una película revés nos daríamos cuenta inmediatamente, pues sucederían situaciones que sabemos que NO se pueden dar, tales como:
- un clavadista que sale hacia arriba impulsado por el agua y cae de pie sobre la tabla del trampolín;
- una cascada de agua que en lugar de caer el agua al río, ésta sube a la montaña;
- una persona que aparentemente está fumando, pero luego nos damos cuenta de que el humo en realidad entra a su boca y que el cigarro crece, o sea que esta transformando nuevamente en tabaco los gases de la combustión.
¿Por qué no suceden esos procesos en la realidad? la razón es la flecha del tiempo avanza solo hacia el futuro estos procesos simplemente no ocurren, son imposibles.
Es decir estos sucesos tiene una dirección (la del avance del tiempo), la dirección inversa no sucede.
Desde luego, ninguno de los procesos descritos, violan la conservación de la energía (primera ley). Para entender esta situación analicemos lo siguiente:
"Imaginemos que vamos en una barca y se nos ocurre absorber el calor del agua del lago, para emplearlo como energía para que el motor de la embarcación funcione, habríamos logrado que se congele el agua del lago y mover la embarcación"
No hemos violado la primera ley de la termodinámica pues no hemos creado energía, pero si ello fuera posible -desde luego, no lo es- tendríamos un magnifico par de negocios: una fábrica de hielo y un taxi acuático, ¡ambos gratis!
Desde nuestra experiencia, conocemos que hay procesos que ocurren siempre, que son espontáneos. La naturaleza nos ha enseñado que un proceso que es espontáneo en un sentido no lo es en el sentido inverso.
Basándote en tu experiencia, indica cuál de los procesos siguientes sucederá y cuál no ocurrirá, a no ser que cambie el sentido de la ocurrencia.
a. Un huevo al caerse al suelo se rompe.
b. El viento puede botar un árbol de raíz.
c. Una manzana se puede volver a colocar en el árbol.
d. Si un trozo de metal a 150 °C se pone en contacto con el agua a 30 °C, el agua se enfría.
e. El hielo se derrite a 20 °C, pero a –10 °C, no lo hace.
De las experiencias citadas, podemos ir pensando que el sentido de un proceso puede depender en gran medida de la temperatura del sistema.
Si analizamos el proceso de fusión del agua, que es endotérmico a presión atmosférica
H2O(s) → H2O(l)
- Cuando T > 0°C, el hielo fundirá espontáneamente, pero a esa misma temperatura y presión, la conversión de agua líquida en hielo será no espontánea.
- Cuando T < 0°C se cumple lo contrario, el agua líquida se convierte en hielo espontáneamente, y la conversión del hielo en agua no es espontánea.
¿Qué sucede a T = 0°C, el punto de fusión normal del hielo?
Recuerda que en el punto de fusión normal de una sustancia, la fase sólida y la líquida se encuentran en equilibrio:
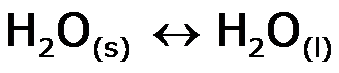
• Lo que significa que se están interconvirtiendo con la misma rapidez.
• El proceso de pasar de sólido a líquido ó de líquido a sólido se produce con la misma preferencia.
• Nos lleva a la conclusión que el proceso no se favorece espontáneamente en un sentido o en el otro.
Siguiendo con el analisis y teniendo en cuenta que el calor (q) y trabajo (w) no son funciones de estado, ambos dependerán de caminos específicos para llegar de un estado a otro.
Si nos imaginamos que:
Fundimos 1 mol de H2O(s) a 0 °C y 1 atm, para formar un mol de H2O(l) a 0 °C y 1 atm
- Para conseguir este cambio debemos agregar cierta cantidad de calor,
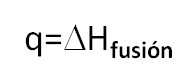
- Si deseamos, volver el sistema a su estado original, simplemente invertimos el procedimiento, es decir quitamos la misma cantidad de calor que agregamos originalmente. Ya que la fusión y congelación del agua a 0°C son proceso reversibles.
- Sin embargo, fundir un mol de hielo, colocándolo en un laboratorio a temperatura ambiente es un proceso irreversible, no podemos seguir el mismo camino de regreso al estado original. La única manera sería reducir la temperatura del agua a 0 °C, para formar de nuevo hielo.
 |
De todo lo analizado podemos concluir que:
|
Entropía
Para comprender el significado de Entropía, analicemos los siguientes esquemas:
- cada uno de estos procesos, suceden os ocurren espontáneamente en el sentido de la flecha:
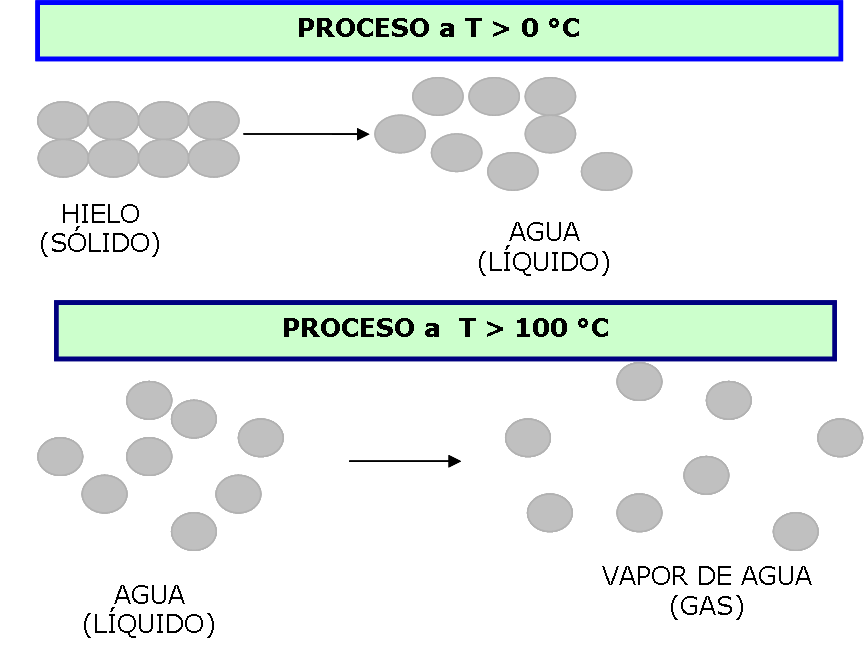
Vayamos estableciendo algunas conluisones. Primero que nada el sentido de la flcha tiene relación directa con la espontaneidad, segundo observen el gado de desorden del sistema; compare el grado de desorden si la flecha fuera en sentido inverso.
En el siguiente proceso, anlaice el grado de desorden del sistema, ¿dónde gana desorden? en el sentido directo de la flecha o en el sentido inverso.
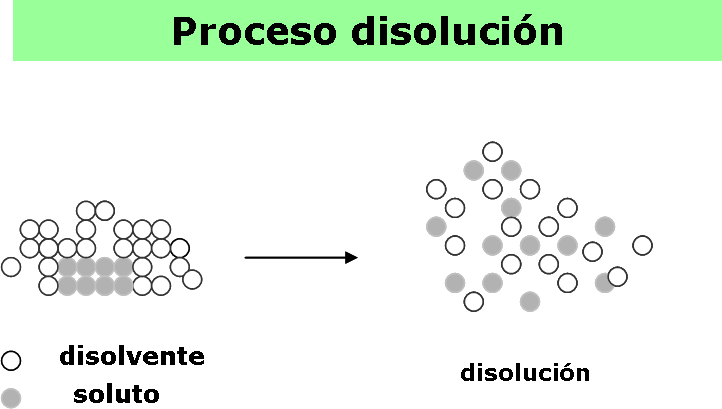
Al observar, cada uno de los procesos de los esquemas anteriores podemos llegar a la conclusión que:
Un proceso tendrá una marcada tendencia a ser espontáneo, si al ocurrir, se favorece el desorden del sistema.
La definición de ENTROPÍA (S), será pues el grado de desorden o aleatoriedad* de un sistema.
*al azar, sin orden establecido
Por lo tanto a medida que aumenta el grado de desorden del sistema, mayor será su entropía, por el contrario cuanto más alto sea el orden de un sistema, menor será el valor de la entropía del mismo.
Ssólido<Slíquido<Sgaseoso
Al igual que la energía y la entalpía, la entropía es una función de estado, por lo tanto:
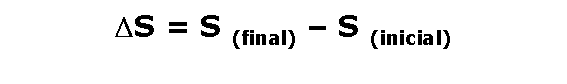
Si la variación de entropía es mayor a cero, esto significará que:

ha aumentado el grado de desorden del sistema, por lo tanto el proceso es: factible, espontáneo. En buena cuenta el proceso sucede.
Por el contrario, si el proceso nos conduce a una disminución del desorden o de la aleatoriedad, entonces la varicación de la entropía será menor a cero

Lo que implicará que el proceso no suceda, no se dé espontánemante.
La conexión entre la ENTROPÍA y la espontaneidad de una reacción queda expresada por la Segunda Ley de la Termodinámica:
La entropía del universo aumenta en un proceso espontáneo y se mantiene constante en un proceso en equilibrio.
Si el universo está constituido por el sistema más el entorno ó alrededores, para cualquier proceso, el cambio de entropía del universo,

será la suma del cambio de entropía del sistema, más el cambio de entropía del entorno o alrededores. La expresión matemática para la Segunda Ley de la Termodinámica será la siguiente:


Cambios de entropía del universo
Queda claro, que según la segunda ley de la termodinámica, que para conocer el grado de desorden del universo, es necesario conocer el grado de desorden del sistema y de sus alrededores.
Vamos a analizar cada uno de estos dos aspectos:
- Cambio de entropía de los alrededores
- Cambio de entroía del sistema
Cambio de entropía de los alrededores
Analicemos que ocurre con la entropia de los alredeores o entorno en un proceso exotermico
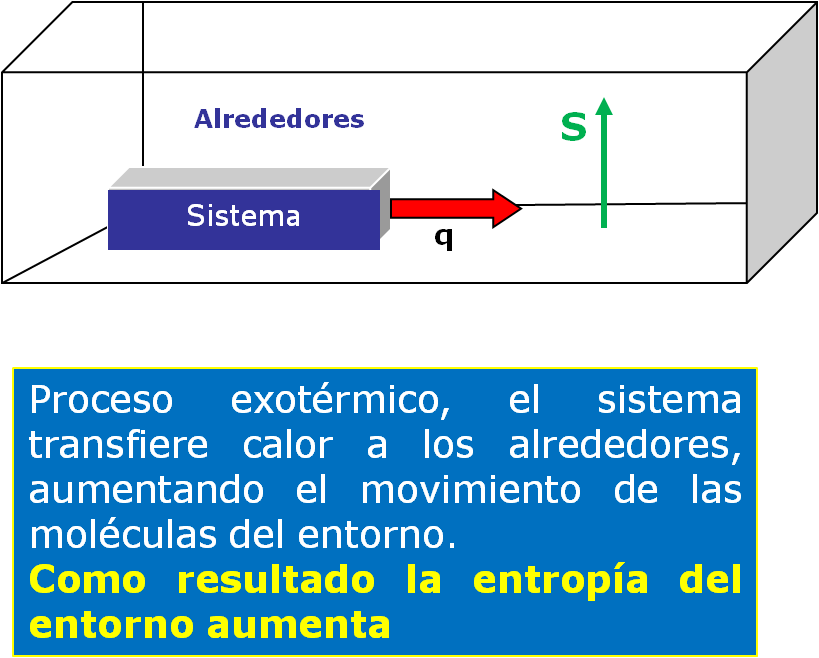
Ahora analicemos que ocurre con la entropia del los alrededores cuando el proceso es endotérmico.

Por lo tanto podemos concluir que la entroía de los alerededores es función de la entalía de reacción, está realción esta dada por la ecuación siguiente:
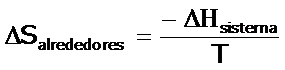
Unidades de la Entropía:

Cambio de Entropía en el sistema
Para calcular el cambio de entropía en una reacción química (sistema), se debe considerar el cambio de entropía de la posición final (productos) a la posición inical (reactantes).
Para una hipotética reacción:
a A + b B → c C + d D
Podemos calcular la entropía estandar de reacción 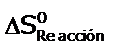

Los valores de S0 se encuentran en tablas.
 |
Ejercicio Suponga que el sistema es una reacción química, tal como la obtención de amoníaco (NH3) |
| La ecuación será: | |
|
Si analizamos los productos tenemos 2 moles gaseosas de NH3, y hemos partido de 1 mol gaseosa de N2 y 3 moles gaseosoas de H2. Por lo tanto el sistema a perdido desorden, lo que nos lleva a pensar que ha pedido entropía. Por lo tanto esperaremos valores de entropia del sistema menores a cero (negativas) |
|
|
Calculamos primero la entropía del sistema, usando los valores estandar de entropia de cada uno de los productos y reactantes: |
|
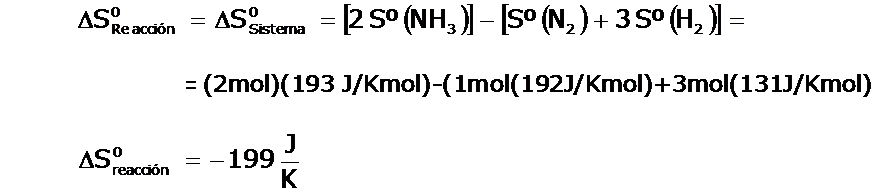 |
|
| Observen que el valor es menor a cero, lo que concuerda con nuestra suposición de que el sistema perdía entropía. | |
|
Luego debemos calcular la entropia del entorno (alrededores), a 298K. Recuerden que los valores encontrados de entropía son estandares por lo tanto han sido medidos a 25°C. |
|
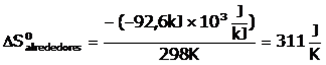 |
|
| La variación de la entropía del universo nos indicará si el proceso es espontáneo o no lo es: | |
 |
|
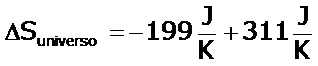 |
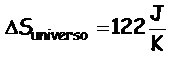 |
|
Conclusiones: Debido a que la entropía del universo es positiva, se predice que la reacción es espontánea a 25°C; es importante recordar que la velocidad puede ser muy lenta aunque sea espontánea. |
|
