2.3.1. Principio de exclusión de Pauli - Principio de Aufbau - Regla de Hund
Principio de exclusion de Pauli
“Dos electrones en un átomo no pueden tener los cuatro números cuánticos iguales”
Si dos electrones tienen iguales n, l y m por tanto se encuentran en el mismo orbital, por lo tanto es necesario que un electrón tenga un s =+1/2 y el otro un s = -1/2
Anlicemos el siguiente ejemplo:
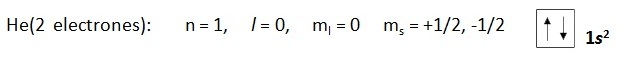
Principio de de llenado progresivo Aufbau (en alemán)
Los electrones pasan a ocupar los orbitales de menor energía, y progresivamente se van llenando los orbitales de mayor energía.
Según el principio de Aufbau, la configuración electrónica de un átomo se expresa mediante la secuencia siguiente:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d….sigue
La regla del serrucho nos ayuda a llenar adecuadamente esta serie.

(Tomado de: http://todosobresechura-quimica.blogspot.com/)
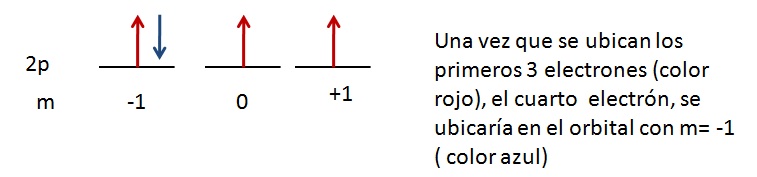
Regla de Hund
Los orbitales con igual nivel de energía ( se refiere a orbitales con el mismo número cuántico n y el mismo número cuántico l), se llenan progresivamente de manera que siempre exista un mayor número de electrones desapareados.
Para comprender esto analicemos a los orbitales 2p, se tienen que llenar con 4 electrones, entonces: