2.7. Catálisis
Observa el siguiente vídeo:
En el vídeo se observa la descomposición del agua oxigenada (H2O2), una sustancia que seguramente tienes en el botiquín de casa. El agua oxigenada se descompone según a siguiente reacción:
2 H2O2(ac) → 2 H2O(l) + O2(g)
Del vídeo, observamos que la reacción es muy lenta: es cierto, nosotros cuando abrimos una botella de agua oxigenada no le vemos burbujas en la superficie. Sin embargo, la reacción se acelera al añadir yoduro (I-). Entonces, ¿cuál es la función del yoduro? ¿Cómo se denomina esta especie?
Aquella sustancia que aumenta la velocidad de una reacción se conoce como catalizador. El proceso de aumentar la velocidad de una reacción se denomina catálisis. En nuestro ejemplo, el yoduro es un catalizador: aumenta la velocidad de descomposición del agua oxigenada.
 |
Observación Existen también sustancias que, en vez de aumentar la velocidad de una reacción, la disminuyen. A estas sustancias se le denominan INHIBIDORES. Encontramos diversos inhibidores en los alimentos envasados: se les añade alguna sustancia que retarde el proceso de descomposición de la comida. |
PROPIEDADES DEL CATALIZADOR
Todo catalizador tiene ciertas propiedades:
- Interviene en el mecanismo de la reacción, pero no se consume. Esto quiere decir que el catalizador participa en alguna etapa de la reacción, pero luego se regenera. Por tanto, si en una reacción determinada colocamos 1 gramo de catalizador, al final de la reacción recuperaremos 1 gramo de la sustancia intacta: no fue consumido.
- Se usa en pequeña cantidad: normalmente se requiere un mínimo porcentaje en moles, con respecto a los reactivos, para observar un incremento en la velocidad.
- Un catalizador NO ALTERA el rendimiento de la reacción. Si una reacción sin catalizador tiene un rendimiento del 70%, al usar un catalizador el rendimiento se mantiene (70% también). Lo único que consigue es que la reacción sea más rápida.
- El catalizador aumenta la velocidad de la reacción al disminuir la energía de activación de la reacción. Por ejemplo, para la reacción exotérmica A → B, los perfiles de energía de la reacción no catalizada y catalizada serían:
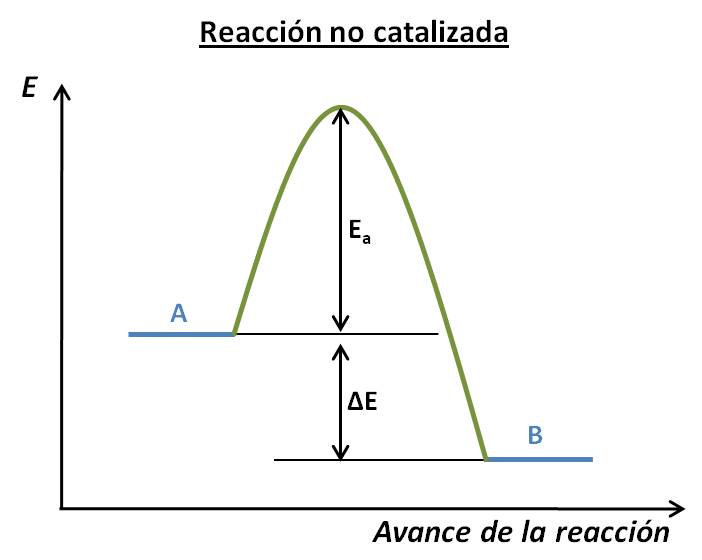
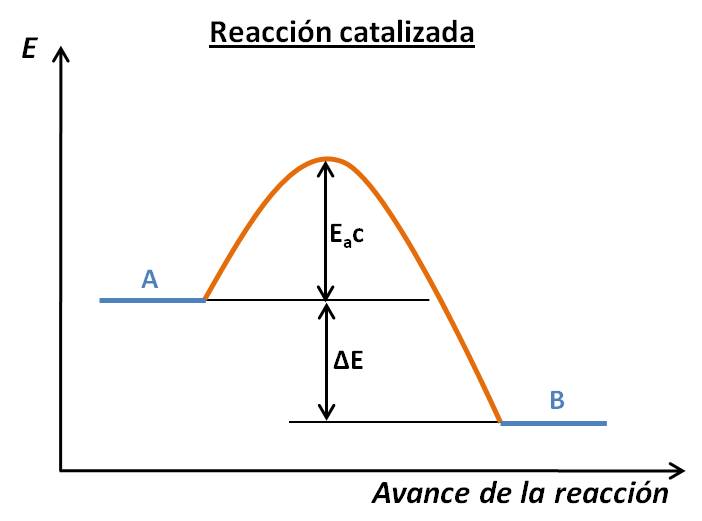
Observa que el ΔE (y consecuentemente el ΔH°) no se afecta ante la presencia del catalizador: lo único que ocurre es una disminución de la energía de activación, lo que origina un aumento de velocidad. Asimismo, ten en cuenta que el catalizador no se indica entre los productos, ya que no ha sido modificado durante la reacción.
TIPOS DE CATÁLISIS
Existen tres tipos de catálisis:
- Homogénea: el catalizador está presente en la misma fase que las especies que reaccionan: todos gases, todos en solución acuosa, etc.
- Heterogénea: el catalizador y los reactivos están en fase distinta: por ejemplo, el catalizador está en fase sólida mientras que los reactivos son gases.
- Enzimática: ocurre sólo en seres vivos, y en estos casos los catalizadores se llaman enzimas: macromoléculas formadas de aminoácidos.
CATÁLISIS HOMOGÉNEA
La reacción que vimos en el vídeo al inicio de este tema es un ejemplo de catálisis homogénea. La reacción que ocurre es la siguiente:
2 H2O2(ac) → 2 H2O(l) + O2(g)
Sin embargo, si añadimos yoduro de potasio (KI) sólido, éste se disuelve en el agua: allí empieza la catálisis, al disponer del ión yoduro I-. El ión yoduro reacciona primero con el agua oxigenada, obteniéndose una reacción en dos pasos:
PASO 1: 2 I-(ac) + H2O2(ac) + 2 H+(ac) → I2(ac) + 2 H2O(l)
PASO 2: I2(ac) + H2O2(ac) → 2 I-(ac) + 2 H+(ac) + O2(g)
GLOBAL: 2 H2O2(ac) → 2 H2O(l) + O2(g)
Observa que el ión yoduro participa como reactivo en el paso 1, pero se produce nuevamente en el paso 2: por tanto, no se altera durante la reacción (requisito para ser catalizador). Asimismo, la reacción global la hemos obtenido sumando ambos pasos: considera que la reacción global es igual a la que ocurría sin el catalizador. El ión yoduro, por tanto, es un catalizador que ha disminuido la energía de activación de la reacción. Asimismo, es una catálisis homogénea, ya que tanto el ión yoduro como el agua oxigenada (el reactivo) están disueltos en agua (misma fase).
CATÁLISIS HETEROGÉNEA
Un ejemplo de catálisis heterogénea es la preparación industrial del polietileno de alta densidad (HDPE). Este polímero se utiliza, por ejemplo, en las tapas de botellas de plástico. Su preparación es más compleja que para preparar el polietileno de baja densidad (LDPE): se requiere un catalizador. La reacción que ocurre se llama polimerización de Ziegler-Natta, en honor a los científicos que descubrieron el catalizador. En este caso, se utiliza un catalizador de titanio mezclado con aluminio (en fase sólida), el cual reacciona con el etileno (C2H4) gaseoso.
El siguiente esquema representa el proceso de obtención del HDPE:
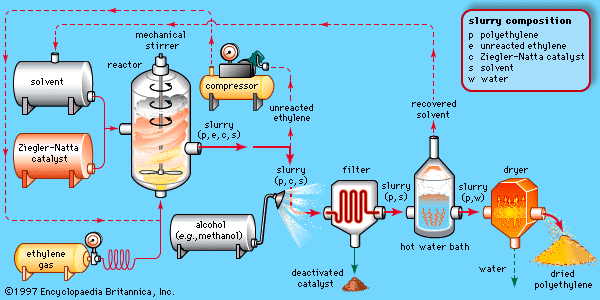
Tomado de: “Encyclopaedia Brittanica Online” (http://www.britannica.com/EBchecked/media/17972/The-Ziegler-Natta-polymerization-of-ethylene-Ethylene-gas-is-pumped)
Otra aplicación de la catálisis heterogénea se da en los motores de los vehículos, donde se produce la transformación de monóxido de carbono (CO) y óxidos nitrosos (NO, NO2) en sustancias menos inocuas, como dióxido de carbono (CO2), oxígeno (O2) y nitrógeno (N2), usando convertidores catalíticos.
 |
Te recomendamos leer el siguiente enlace para saber más de los convertidores catalíticos: http://www.ehu.es/zorrilla/juanma/automovil/catalitico.htm |
CATÁLISIS ENZIMÁTICA
Nuestro cuerpo tiene que realizar infinitas reacciones químicas para que podamos vivir. Por ejemplo, tiene que transformar los carbohidratos en energía mediante una combustión, de manera eficiente y rápida. Sin embargo, nuestro cuerpo siempre trabaja a la misma temperatura: 37°C. ¿Cómo entonces puede hacer una “combustión” sin calor, y de manera rápida?
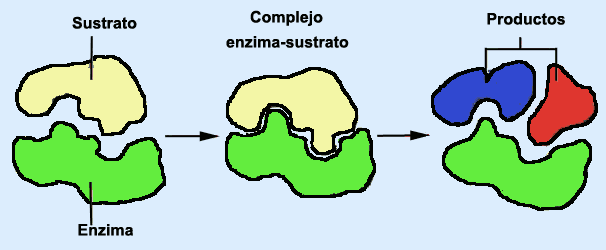
Nuestro organismo cuenta con macromoléculas llamadas enzimas, que son los catalizadores biológicos por excelencia. Las enzimas cuentan, dentro de su gran estructura, con “sitios activos”, que son lugares favorecidos para la unión de otras sustancias (llamada sustrato), mediante fuerzas intermoleculares apropiadas.
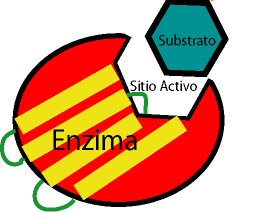
Es en el sitio activo donde ocurre la transformación del sustrato. Lo importante del sitio activo es su alta especificidad: sólo un único sustrato encaja en él (similar a una pieza de un rompecabezas) y puede allí ser transformado. Otras moléculas no pueden ser modificadas por esa enzima, pero sí, quizá por otra.
Los orientales, especialmente la gente de China, carecen de una enzima: la acetaldehídodeshidrogenasa. Al faltarles esta enzima, no pueden procesar el alcohol de las bebidas alcohólicas. Es por ello que muchas personas orientales tienen problemas al beber alcohol: se producen hinchazones y la piel se torna roja.
 |
Más sobre la deficiencia de esta enzima: http://www.20minutos.es/noticia/463756/1/cancer/alcohol/bebida/ |
