3.1 Introducción
¿Qué ocurre cuando se consumen los reactivos de una reacción química?, ¿quiere decir que ésta ha terminado?, ¿que ya no hay más transformaciones a nivel molecular? ¡¡Podríamos estar equivocados!!
Conforme transcurre el tiempo después de iniciada la reacción, se va incrementado la cantidad de moléculas de productos, los choques entre éstas se vuelven más probables y en consecuencia, puede ocurrir una reacción en el sentido inverso, donde nuevamente se forman los reactivos originales.
Cuando la mezcla de reacción deja de cambiar, lo que sucede es que la transformación de reactivos a productos tiene en ese momento la misma velocidad que la transformación de productos a reactivos, entonces podemos afirmar que se ha alcanzado el equilibrio químico.
En ciertas reacciones químicas se observa claramente que los reactivos no llegan a consumirse totalmente, que se detienen antes de completarse. Tales reacciones son reversibles, es decir, los reactivos originales forman productos, pero entonces los productos reaccionan nuevamente con ellos mismos para dar los reactivos originales. Ocurren dos reacciones opuestas a igual velocidad: se ha alcanzado el equilibrio químico. El resultado eventual, es una mezcla de reactivos y productos en concentraciones definidas, más que una simple mezcla de productos.
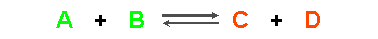
|
|
Observación Podemos afirmar entonces que el equilibrio químico se caracteriza en que dos procesos opuestos se llevan a cabo simultáneamente y con la misma velocidad. El equilibrio químico es un proceso dinámico, en el que microscópicamente hay un cambio (los reactivos se transforman en productos a la misma velocidad que los productos se transforman en reactivos) que macroscópicamente es indetectable (las concentraciones de las especies en la mezcla de reacción no varían). Para alcanzar el equilibrio, ni los reactivos ni los productos escapan del sistema. |
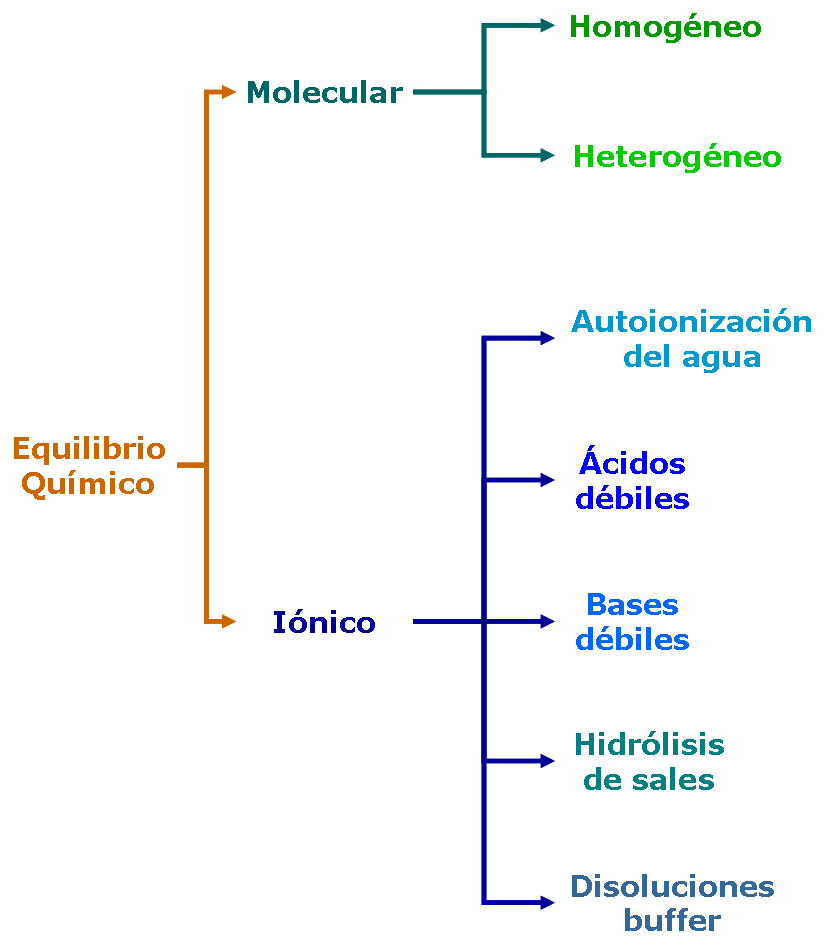
Clasificación del equilibrio químico
Los tipos de equilibrio que vamos a estudiar los podemos clasificar según: