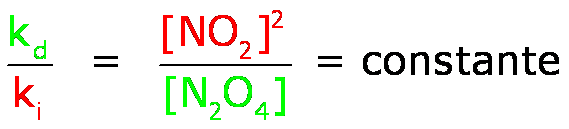3.1.1. Aspecto Cinético
Analicemos la primera característica del estado de equilibrio: dos reacciones que se producen simultáneamente, en sentidos opuestos y a la misma velocidad: el aspecto cinético del equilibrio.

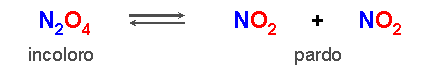
El tetróxido de dinitrógeno, N2O4, es una sustancia incolora que se descompone cuando se calienta, para dar dióxido de nitrógeno, NO2, una sustancia de color pardo.
 |
Si en un cilindro cerrado colocamos una determinada cantidad de N2O4(g), al que representaremos por esferas blancas, a nivel molecular visualizaríamos que:
Podemos afirmar que la reacción de descomposición del N2O4 ha alcanzado el equilibrio químico. |
 |
A nivel molecular, ¿qué ocurre dentro del cilindro?: * ¿se habrá paralizado la reacción? * ¿las moléculas se quedarán estáticas? |
Si calentamos N2O4(g) por encima de la temperatura ambiente, se descompone a NO2(g), el cual puede ser detectado por la intensidad creciente del color pardo:
N2O4(g) → NO2(g) + NO2(g) reacción directa
Una vez producido el NO2(g) puede reaccionar para volver a formar N2O4(g):
NO2(g) + NO2(g) → N2O4(g) reacción inversa
Estas reacciones son elementales, entonces sus ecuaciones de velocidad serán:
Reacción directa: vd = kd[N2O4]
Reacción inversa: vi = ki[NO2]2
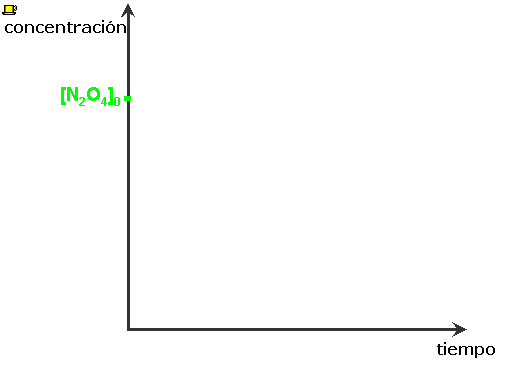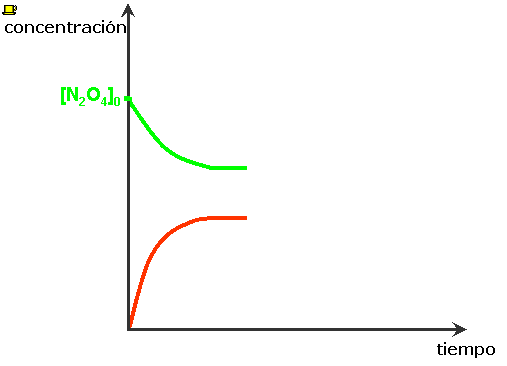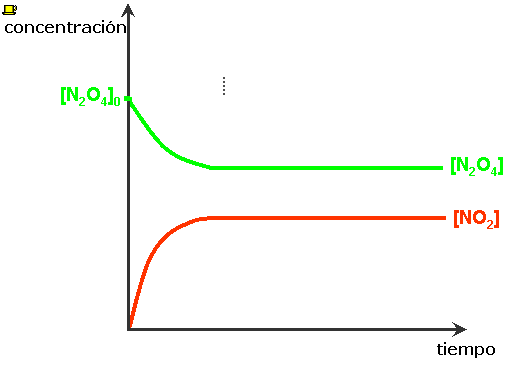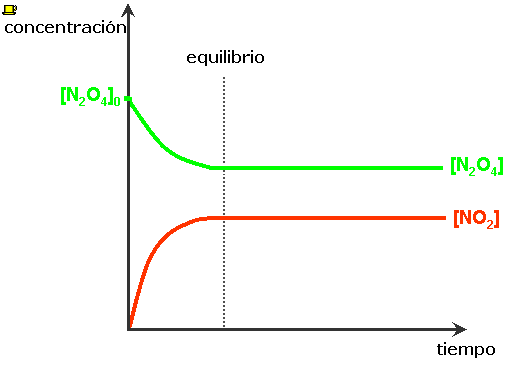
Al inicio sólo tenemos N2O4(g), la velocidad de la reacción directa es relativamente grande y va disminuyendo a medida que la [N2O4] disminuye. Al formarse el NO2(g) se incrementa la [NO2], y la velocidad de la reacción inversa, inicialmente pequeña, aumenta.
 |
En algún momento las dos velocidades se hacen iguales y cada vez que se descompone una molécula de N2O4, se forman dos moléculas de NO2. Las concentraciones de N2O4 y de NO2 no cambian, aunque las reacciones directa e inversa, continúan efectuándose. ⇒ La reacción ha alcanzado el equilibrio químico. |
Una vez alcanzado el equilibrio podemos escribir:
vd = vi
kd[N2O4] = ki[NO2]2