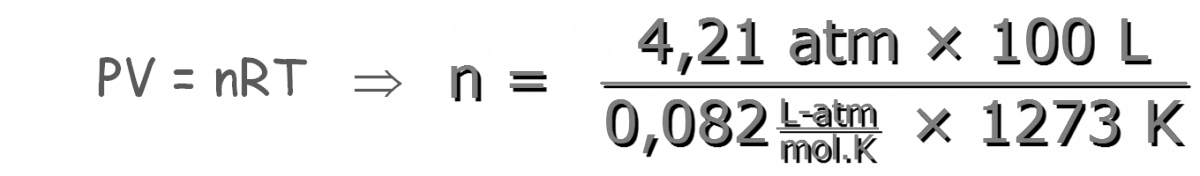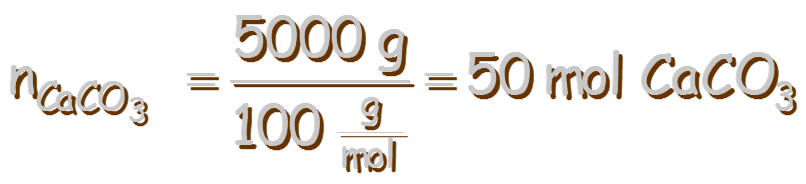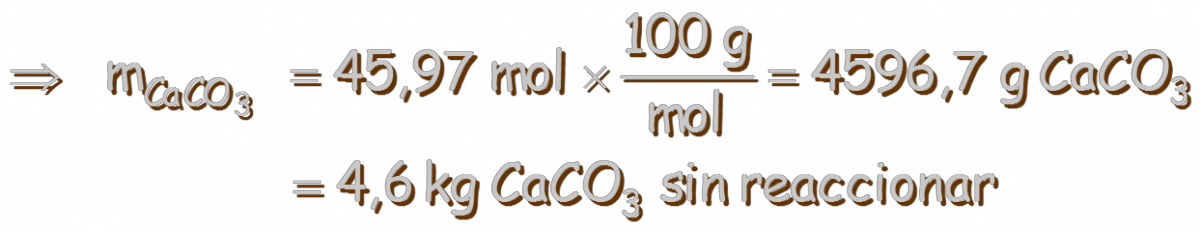3.4. Equilibrio Molecular
El equilibrio molecular es aquel en el que todas las sustancias participantes son moleculares. Éste puede ser de dos tipos, homogéneo y heterogéneo.
Equilibrio Homogéneo
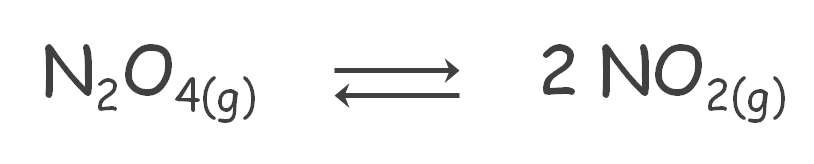
El término se aplica a las reacciones en las que todas las especies participantes (reactivos y productos) se encuentran en la misma fase, como:


Por ejemplo:
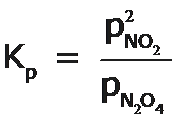
Equilibrio Heterogéneo
Una reacción reversible en la que intervienen reactivos y productos en distintas fases conduce a un equilibrio heterogéneo, por ejemplo:

Donde los dos sólidos y el gas constituyen fases distintas a una misma temperatura.
Debemos recordar:
| Estado de la materia | Actividad, a |
|---|---|
| gases | presión parcial, p |
| sólidos puros | 1 |
| líquidos puros | 1 |
| disoluciones | molaridad, M, (mol/L) |
Como sabemos, K se define en términos de actividades, a, que son magnitudes adimensionales, en consecuencia, para la reacción dada, su constante de equilibrio será:

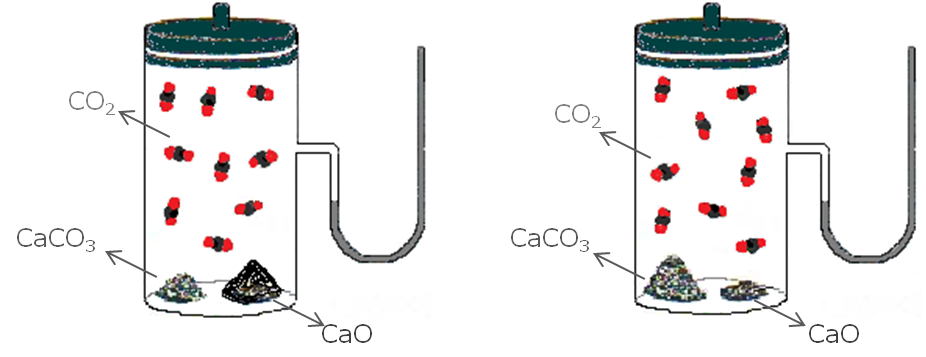
El valor de K no depende de las cantidades de CaCO3(s) y CaO(s) presentes, siempre y cuando algo de cada uno de ellos se encuentren presentes en el equilibrio:
 |
Importante A pesar que los sólidos y líquidos puros no aparecen en la expresión de la constante de equilibrio, K, éstos deben estar presentes para que se establezca el equilibrio. |
 |
Problema A determinada temperatura, se colocan 5 kg de CaCO3(s) en un recipiente herméticamente cerrado y se deja alcanzar el equilibrio. Se sabe que a dicha temperatura, el valor de Kp es 4,21. Determina la masa de CaCO3(s) que permanece sin reaccionar una vez alcanzado el equilibrio. Solución
⇒ n = 4,033 mol de CO2 formadas El CO2(g) se formó por las moles de CaCO3(s) que se descompusieron, que será estequiométricamente igual a las moles de CO2(g) formadas, por lo que primero calculamos las moles iniciales de CaCO3(s):
luego calculamos las moles de CaCO3(s) que permanecen en el equilibrio: ⇒ nsin reaccionar = 50 – 4,033 = 45,97 mol de CaCO3 y finalmente la masa de CaCO3(s) que permanece en el equilibrio:
|
 |
Ejercicio Continuando con el estudio del equilibrio anterior,
|