3.4.1. Cómo determinar la estructura de Lewis: Teoría RPECV
La teoría RPECV (repulsión de pares electrónicos de la capa de valencia) permite deducir la estructura de Lewis de un compuesto determinado, basándose en el número de electrones de valencia de los átomos que conforman dicho compuesto. Para ello debemos seguir una serie de pautas que se resumen en los cinco puntos siguientes:
- Debemos identificar cuál será el átomo central (en el caso de que existan más de dos átomos). Normalmente, el átomo central será el menos electronegativo. Excepción a esta regla es el hidrógeno, ya que este elemento sólo puede tener alrededor de él dos electrones.
- Contamos los electrones de valencia de todos los átomos, teniendo en cuenta, también, la carga (si se trata de un ión).
- Contamos los electrones totales que debería haber si todos los átomos tuviesen completo su octeto.
- La diferencia de (3) – (2) nos dará el número de electrones enlazados.
- Se completa el octeto a cada átomo, verificando que el número de electrones dibujado coincida con el calculado en (2).
 |
Ejemplo 3.3. Hallar la estructura de Lewis del trifluoruro de nitrógeno (NF3). |
Es un compuesto con enlaces covalentes, dado que está formado por no metales.
1. El átomo central tendrá que ser el nitrógeno, dado que el flúor es el elemento más electronegativo de la tabla periódica.
2. Electrones de valencia:
N (grupo 5): 5 e-
F (grupo 7): 7 e- x 3 = 21 e-
Total de electrones de valencia: 5 + 21 = 26 e-
3. Si todos los elementos tuviesen el octeto completo:
N: 8 e-
F: 8e- x 3 = 24 e-
Total de electrones: 8 + 24 = 32 e-
4. Restamos (3) – (2) para tener el número de electrones enlazados: 32 – 26 = 6 e-, lo cual equivale a tres enlaces. Y como hay que unir tres átomos de flúor al átomo central (nitrógeno), cada unión será un enlace simple.
5. Representamos la estructura:
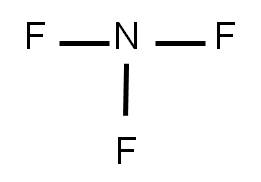
Nos queda completar el octeto a cada átomo que conforma la molécula. Para ello, colocamos pares libres a cada átomo:
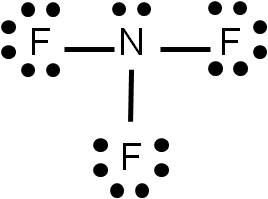
Verificamos finalmente que el número de electrones que hemos representado es correcto con el que calculamos en el punto (2). Hemos dibujado 10 pares libres (20 electrones) y 3 enlaces (6 electrones). La suma da 26 electrones, igual resultado al estimado en el punto (2).
 |
Ejemplo 3.4. Determinar la estructura de Lewis del ácido cianhídrico, HCN. |
Nuevamente, antes de empezar, verificamos que existen sólo enlaces covalentes en dicha molécula, dado que los tres átomos que la conforman son no metales.
1. El átomo central es el carbono, ya que es menos electronegativo que el nitrógeno (recordar que el hidrógeno nunca es átomo central).
2. Electrones de valencia:
H (grupo 1): 1 e-
C (grupo 4): 4 e-
N (grupo 5): 5 e-
Total de electrones de valencia: 1 + 4 + 5 = 10 e-
3. Si los elementos tuviesen su octeto, tendríamos:
H: 2 e- (recordar que el octeto del hidrógeno es de sólo dos electrones)
C: 8 e-
N: 8 e-
Total de electrones: 2 + 8 + 8 = 18 e-
4. Restamos (3) – (2): 18 – 10 = 8 e- = 4 enlaces.
5. Sabemos que el hidrógeno sólo puede formar un único enlace simple (ya que sólo puede rodearse de dos electrones). Por tanto, el nitrógeno debe unirse al carbono mediante un enlace triple. Representamos la estructura:
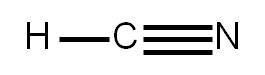
Nos queda completar el octeto a cada átomo. Vemos que el hidrógeno ya tiene su “octeto” completo, pues él sólo puede tener alrededor dos electrones. Asimismo, el carbono tiene alrededor ocho electrones (está formando cuatro enlaces covalentes). Sólo falta completar el octeto al átomo de nitrógeno:
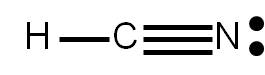
Verificamos el número de electrones representados en la estructura: hemos dibujado 4 enlaces (8 electrones) y un par libre (2 electrones), o sea, 10 electrones en total, resultado que coincide con el valor estimado en el punto (2).
 |
Ejercicio 3.4 Representa las estructuras de Lewis del dióxido de azufre (SO2) y del monóxido de carbono (CO). |
Iones poliatómicos
Existen especies iónicas conformadas por dos o más átomos no metálicos, unidos mediante enlaces covalentes. La especie global lleva una carga, ya sea positiva (catión) o negativa (anión). A estas especies se les llama iones poliatómicos. Iones de este tipo son, por ejemplo, amonio NH4+ y el ión carbonato CO32-, presente en el agua carbonatada. Para ellos también es posible representar su estructura de Lewis. El cuidado que hay que tener es considerar la carga del ión al momento de contar los electrones de valencia: un catión implica la pérdida de un electrón por cada carga positiva, mientras que en el caso de un anión tendremos que aumentar un electrón por cada carga negativa.
 |
Ejemplo 3.5. Construir, aplicando las reglas aprendidas en el tema anterior, la estructura de Lewis del ión amonio NH4+. |
Este ión presenta enlaces covalentes, ya que está formado por no metales.
1. El átomo central será necesariamente el nitrógeno. Hay, por tanto, que ubicar cuatro átomos de hidrógeno alrededor de él.
2. Contamos electrones de valencia:
N (grupo 5): 5 e-
H(grupo 1): 1 e-
En total, 9 electrones. PERO, hay que considerar la carga (+1), que implica la pérdida de un electrón. Entonces:
Electrones de valencia: 9 – 1 = 8 e-
3. Contamos los electrones que habrían con el octeto completo:
N: 8 e-
H: 2 e- x 4 = 8 e-
Total: 16 e-
4. Restamos (3) – (2) y obtenemos 8 electrones, lo cual corresponde a cuatro enlaces.
5. Como hay que unir cuatro átomos de hidrógeno usando cuatro enlaces, la estructura que obtenemos será:
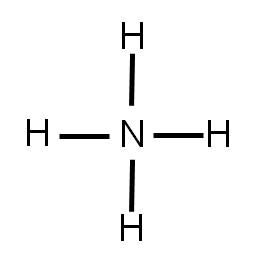
Nota que en la estructura, todos los átomos tienen su octeto completo. Falta únicamente indicar la carga total de dicha especie. Para ello, se encierra a la especie entre corchetes y se coloca la carga afuera, como superíndice:
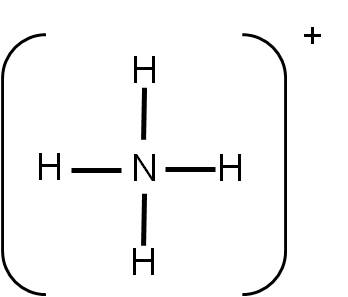
Esta es la estructura de Lewis correcta del ión amonio.
 |
Ejercicio 3.5 Aplica lo anterior para demostrar que la siguiente es la estructura de Lewis del ión carbonato CO32-:
|
 |
Observación Los iones poliatómicos presentan enlaces covalentes para unir a los átomos que lo conforman. Sin embargo, ellos pueden estar formando enlaces iónicos. Un ejemplo es el carbonato de calcio CaCO3: este compuesto iónico, ingrediente de las gaseosas, presenta el catión calcio (Ca2+) y el anión carbonato (CO32-), los cuales se atraen entre sí por atracción electrostática. Sin embargo, el anión carbonato puede presentar enlaces covalentes, ya que es un ión poliatómico. |
Estructuras resonantes
Si realizaste el ejercicio 3.5, sobre la estructura de Lewis del ión carbonato (CO32-), habrás tenido la siguiente duda: ¿cómo uno tres átomos usando cuatro enlaces? La respuesta es sencilla: colocando a uno de ellos un enlace doble. Pero aquí surge otra pregunta: ¿cuál átomo de oxígeno será el que una con un enlace doble?
Cuando tenemos esta situación, en la que existe más de una posibilidad de representar la estructura de Lewis de un compuesto dado, se dice que existe RESONANCIA. En el caso del ión carbonato, podemos tener tres estructuras posibles:
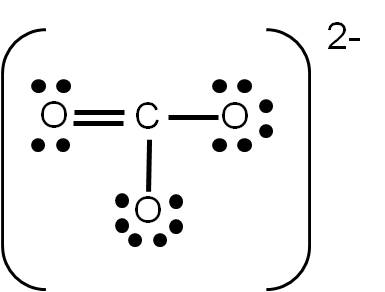
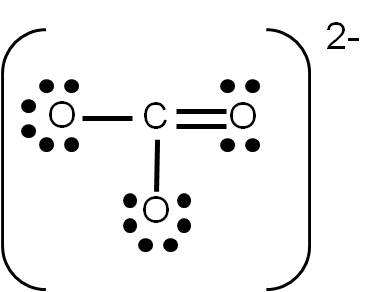
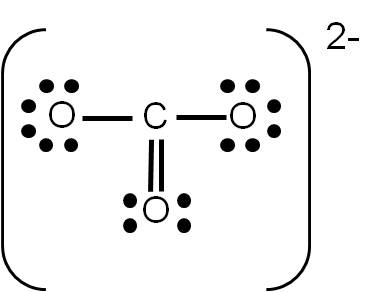
Observa que las tres estructuras son correctas: cumplen con el número de electrones de valencia calculados previamente y cada átomo tiene el octeto completo. Por tanto, son ESTRUCTURAS RESONANTES: representan la estructura del ión carbonato por igual, y cualquiera de ellas es electrónicamente correcta. Las estructuras resonantes se suelen separar por medio de fechas con doble punta (ver ejemplo siguiente).
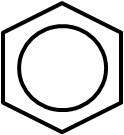
Otro compuesto conocido por presentar estructuras resonantes es el benceno, C6H6:
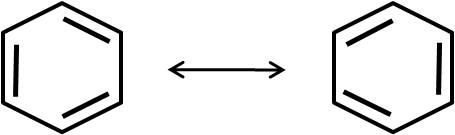
Sin embargo, se ha demostrado que aquellas especies que presentan estructuras resonantes tienen, en realidad, una estructura que es el resultado de la combinación de todas sus estructuras resonantes. En el caso del benceno, éste se suele representar de la siguiente forma: