3.6.1. Teorías ácido - base
Teorías ácido - base
En este capitulo analizaremos dos de las definiciones de los ácidos y bases, teniendo en cuenta su comportamiento al disolverlos en agua pura.
 |
Teoría de Arrhenius
|
Por ejemplo, cuando el cloruro de hidrógeno gaseoso, HCl, se disuelve en agua, se disocia en iones hidrógeno, H+, y iones cloruro, Cl–:

Esta solución es lo que conocemos como ácido clorhídrico, el cual es el responsable de la digestión en el estómago.
Los ácidos orgánicos contienen el grupo carboxilo, -COOH, el cual libera el ion hidrógeno, H+. Por ejemplo, para el ácido acético, CH3COOH, (componente principal del vinagre):
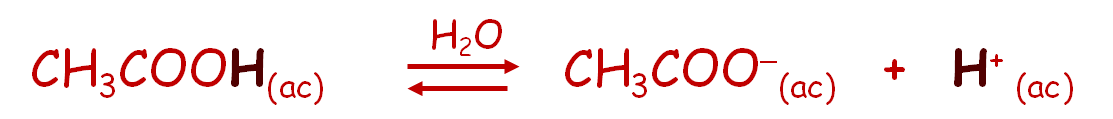
Cuando el hidróxido de sodio, NaOH, se disuelve en agua, se disocia en iones sodio, Na+ y iones hidroxilo, OH–:
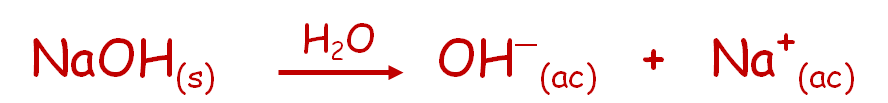
 |
Teoría de Brönsted – Lowry
|
Según esta teoría, cuando el ácido acético, CH3COOH, se disuelve en agua, algunas de sus moléculas se disocian transfiriéndole un protón, H+, convirtiéndose en el ión acetato, CH3COO-. Por su parte, el agua, H2O, se comporta como base al aceptar el protón, H+, convirtiéndose en el ion hidronio, H3O+:
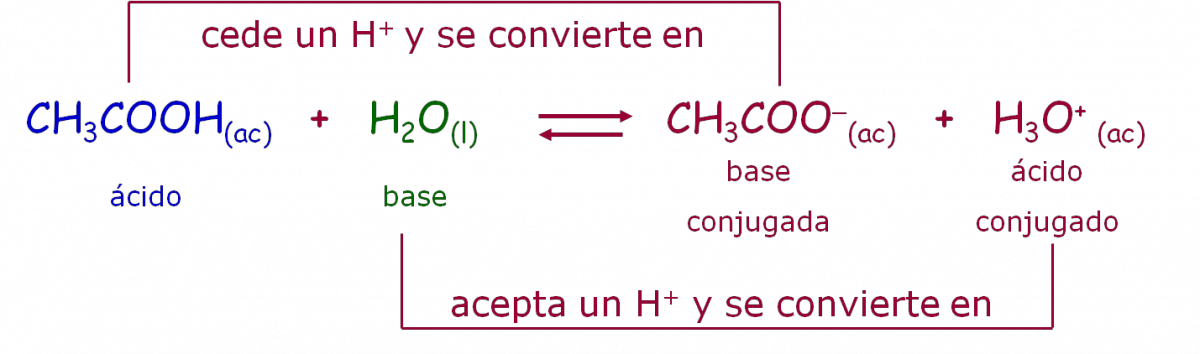
La teoría de Brönsted – Lowry permite ampliar el rango de sustancias que pueden clasificarse como bases, por ejemplo el amoníaco, NH3:
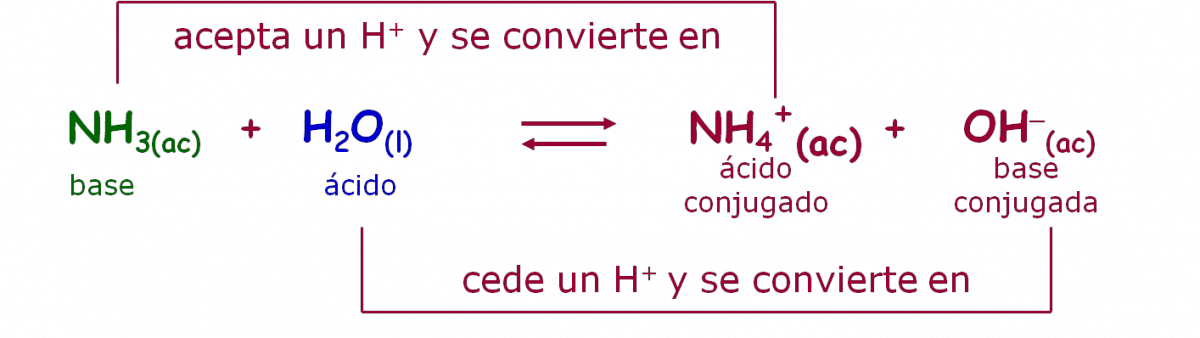
A una base y un ácido que difieren sólo en la presencia o ausencia de un protón, se les conoce como par conjugado ácido-base:
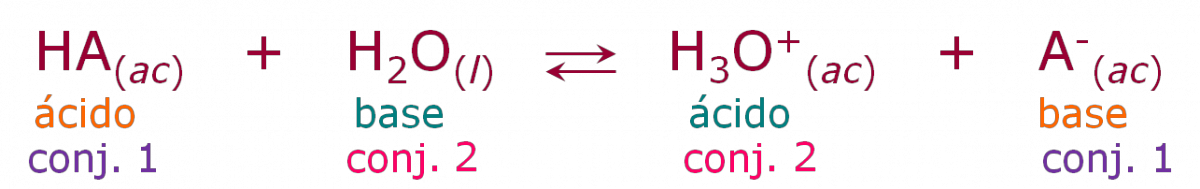

- base conjugada es la porción que queda de la molécula del ácido, después que transfiere el protón.
- ácido conjugado se forma cuando el protón se transfiere a la base.
Como se puede observar, el agua puede comportarse como ácido en algunos casos y en otros como base, por eso se dice que es un anfótero.
|
|
Ejercicios
|

