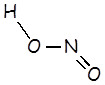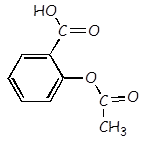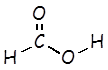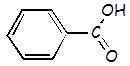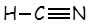3.6.2. Fortaleza de ácidos
Fuerza de Ácidos
La fuerza de los ácidos está determinada por su capacidad para disociarse en iones en disolución acuosa. Se dice que un ácido es fuerte si está totalmente disociado y es débil si la disociación es parcial:
ácido fuerte: HX + H2O → H3O+ + X- 
ácido débil: 
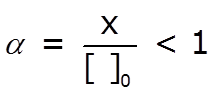
|
[ ]0 |
[ ]0 |
0000000 |
— |
— |
|
[ ]reacciona |
x |
|
— |
— |
|
[ ]forma |
— |
|
x |
x |
|
[ ]eq |
[ ]0 - x |
|
x |
x |
Como vemos, los ácidos débiles forman un sistema en equilibrio cuando se disuelven en agua. La expresión de la constante de equilibrio, en términos de concentraciones se denomina Ka, constante de disociación ácida:
 o
o 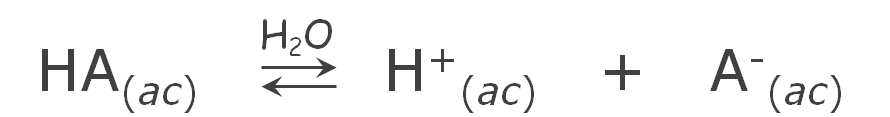
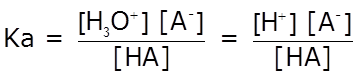
Observando la expresión de Ka podemos concluir que:
- conforme se incrementa la [H3O+], aumentará el valor de Ka y el del grado de ionización, α.
- cuanto mayor es el valor de α, el ácido será menos débil, y en consecuencia, mayor es el valor de Ka.
 |
A mayor valor de Ka ⇒ menos débil o relativamente más fuerte es el ácido. |
Las diferencias el ácido fuerte y el ácido débil las podemos resumir en:
| Ácido Fuerte | Ácido Débil |
|---|---|
|
|
En el siguiente video puedes visualizar estas diferencias:
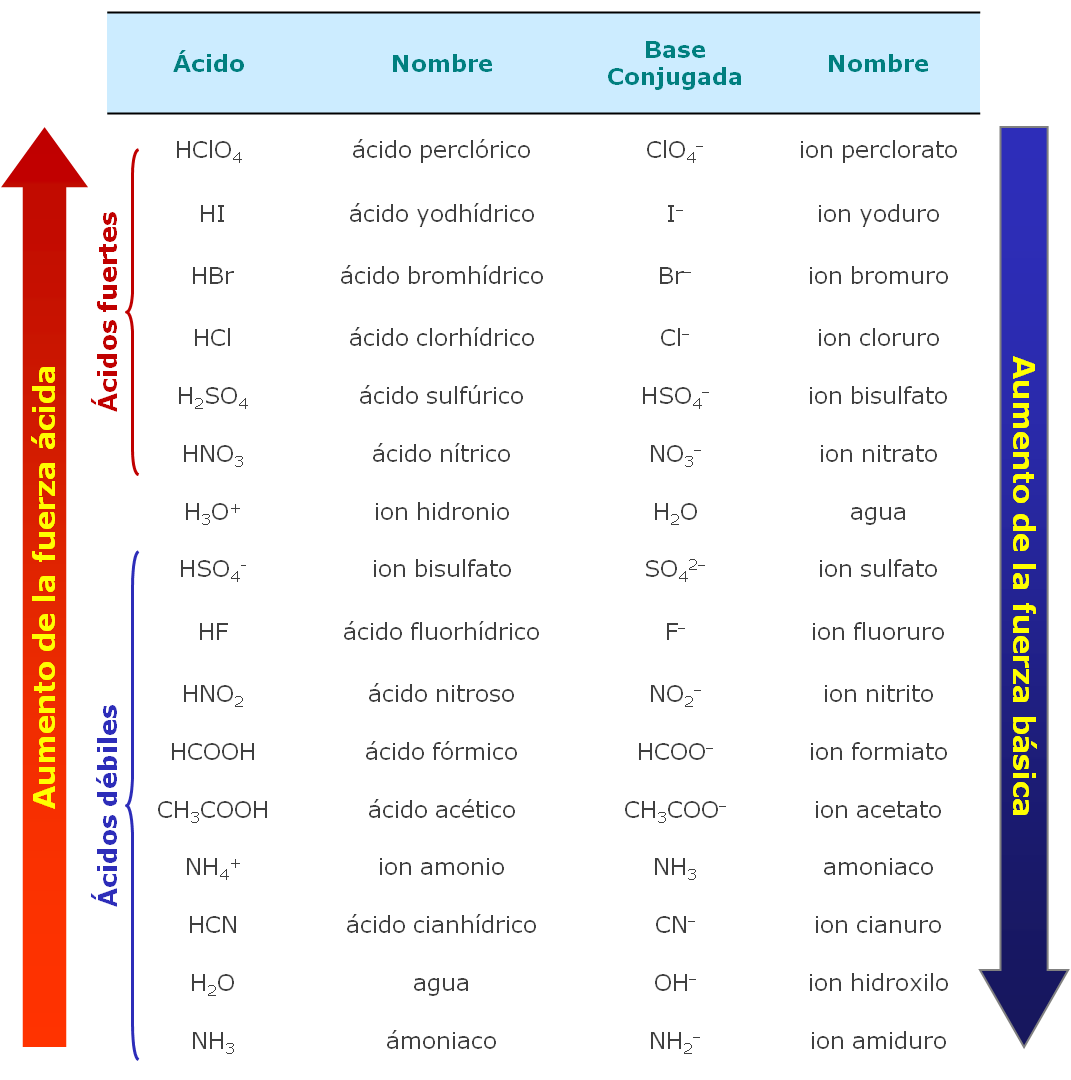
A continuación te presentamos los seis ácidos fuertes y luego una pequeña relación de ácidos débiles mas comunes, junto con unos datos adicionales.
| Ácidos Fuertes | |
|---|---|
| HCl |
ácido clorhídrico |
| HBr |
ácido bromhídrico |
| HI |
ácido yodhídrico |
| HNO3 |
ácido nítrico |
| H2SO4 |
ácido sulfúrico |
| H3ClO4 |
ácido perclórico |
Constante de Ionización de algunos Ácidos Débiles A 25 ºC
|
Nombre |
Fórmula |
Estructura |
Ka |
Base conjugada |
|---|---|---|---|---|
|
Ácido fluorhídrico |
HF |
H—F |
7,1 x 10-4 |
F- |
|
Ácido nitroso |
HNO2 |
|
4,5 x 10-4 |
NO2- |
|
Ácido acetilsalicílico |
C9H8O4 |
|
3,0 x 10-4 |
C9H7O4- |
|
Ácido fórmico |
HCOOH |
|
1,7 x 10-4 |
HCOO- |
|
Ácido benzoico |
C6H5COOH |
|
6,5 x 10-5 |
C6H5COO- |
|
Ácido acético |
CH3COOH |
|
1,8 x 10-5 |
CH3COO- |
|
Ácido cianhídrico |
HCN |
|
4,9 x 10-10 |
CN- |
 |
Ejercicio Considera las soluciones de dos ácido débiles, HA y HB, con las siguientes características:
Para las dos soluciones ácidas, analiza lo siguiente:
|
A continuación se muestra la relacion entre las fortalezas ácido - base de algunos pares conjugados: