3.6.4. Autoionización del agua y escala de pH
El agua como ácido y como base
El agua pura es neutra, no muestra las propiedades de un ácido ni de una base. Sin embargo, esta neutralidad no quiere decir que en el agua pura no existan iones H3O+ ni OH–.
Recordemos que en la definición de Brönsted-Lowry vimos que el agua puede comportarse ya sea como ácido o como base, dependiendo de la especie con la que interactúa:
- tiene átomos de hidrógeno capaces de ser cedidos a otra especie.
- el átomo de oxígeno tiene pares libres capaces de aceptar un protón.
Si consideramos dos moléculas de agua, donde una se comporta como ácido y la otra como base, tendremos:
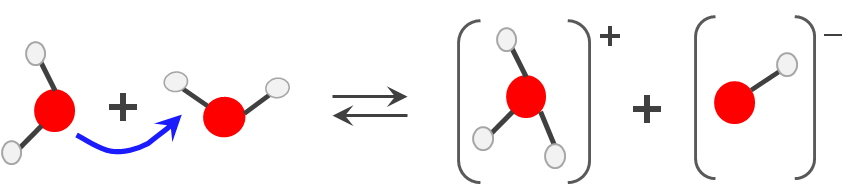
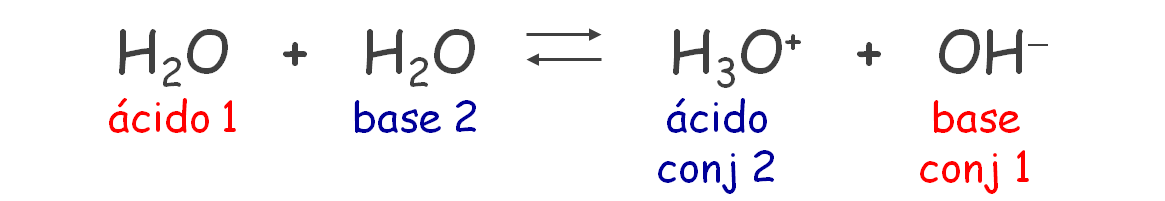
En este caso, la constante en términos de concentraciones, se denomina Kw, constante del producto iónico del agua:
Kw = [H3O+] [OH-]
De la ecuación de equilibrio de la autoionización del agua podemos deducir que, en el agua pura la [H3O+] es igual a la [OH-]:
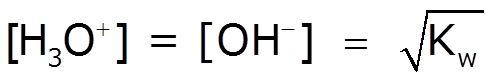
Cuando al agua se le añade un ácido, la concentración de iones H3O+ se incrementa, a la vez que la concentración de los iones OH- disminuye, de manera que el producto [H3O+] [OH-] se mantenga constante. Esto provoca que dominen las propiedades ácidas, o sea que la concentración de H3O+ sea mayor que la de los iones OH–.
Por el contrario, si se añade una base al agua, es la concentración de iones OH– la que aumenta, mientras que la de los iones H3O+ disminuye, tornándose la solución en básica, donde la concentración de iones H3O+ es menor que la de los iones OH–, de manera que el producto [H3O+] [OH-] se mantiene constante.
A 25 °C, Kw = 1 x 10–14, por lo tanto en el agua pura:
[H3O+] = [OH-] = 1 x 10–7 M
 |
[H3O+] = [OH-] agua pura y soluciones neutras [H3O+] > [OH-] soluciones ácidas [H3O+] < [OH-] soluciones básicas |
La escala de pH
Expresar la concentración de los iones H3O+ y OH– en números tan pequeños resulta engorroso, por lo que en 1909 se definió la escala de pH, del francés pouvoir hidrogene, poder del hidrógeno. La definición matemática de pH es:
pH = – log [H3O+]
y se acostumbra definir también: pOH = – log [OH–]
y análogamente: pKw = – log Kw
pKa = – log Ka
pKb = – log Kb
Como la [H3O+] se relaciona con la [OH–], a través de Kw, se cumple que:
pH + pOH = pKw
y a 25 °C: pH + pOH = 14
 |
Como la escala de pH es logarítmica, una diferencia de una unidad implica un cambio en la acidez de 10 veces. El pH indica la acidez de una disolución, mientras que la fuerza del ácido está caracterizada por su porcentaje de disociación. Cuando el pH se incrementa, el pOH disminuye. |
Aquí un video que te ayudará a visualizar y entender la escala de pH:
