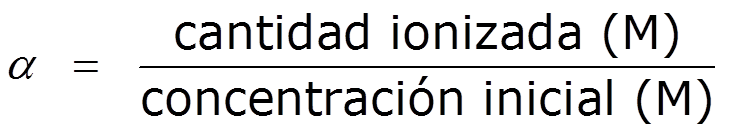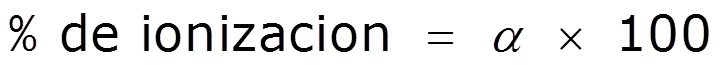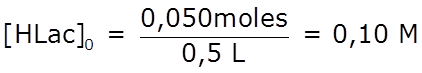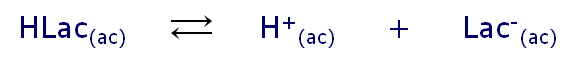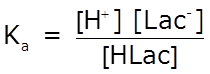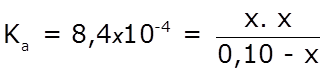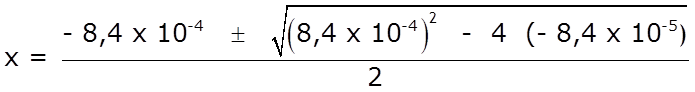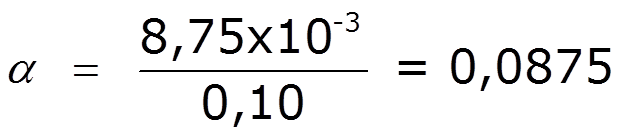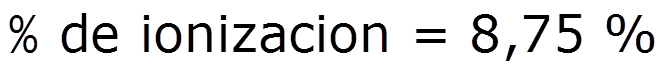Resolución de problemas de equilibrio de ácidos y bases débiles
Los cálculos en el equilibrio iónico, en particular con ácidos y bases débiles, es similar al empleado en el equilibrio molecular, solo que como trabajamos con partículas iónicas en disoluciones acuosas, debemos trabajar con concentraciones, en términos de molaridad, M.
 |
- Identifica las especies principales presentes en la solución.
- Selecciona la especie que puede producir iones H+ o iones OH–, según sea el caso y escribe la reacción de ionización.
- Escribe la expresión de la constante de equilibrio.
- Tabula las concentraciones iniciales y en el equilibrio.
- Escribe las concentraciones en el equilibrio en términos de x.
- Sustituye en la expresión de equilibrio, las concentraciones en equilibrio, en términos de x.
- Resuelve para x, recuerda que puedes aplicar la “forma aproximada”.
- Calcula [H+] o [OH–] según corresponda, el grado de ionización y el pH.
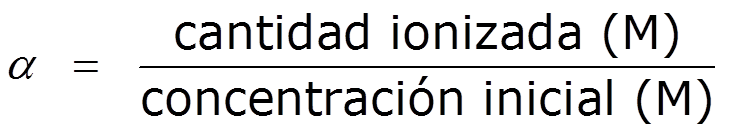
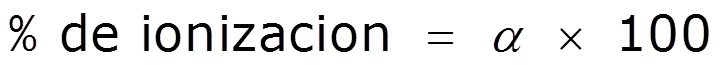
|
 |
Ejercicio
El ácido láctico, CH3CHOHCOOH (HLac), recibe su nombre de la leche agria, de la cual se aisló por primera vez en 1780. A 25 °C el Ka para el HLac es 8,4 x 10–4. Si tenemos 500 mL de una solución de leche agria que contiene 0,050 moles de HLac, como componente ácido:
- determinamos la concentración inicial de HLac:
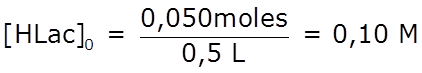
- podemos escribir la ecuación de equilibrio y hacer el balance:
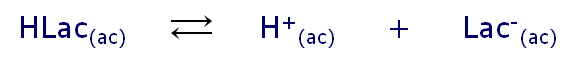
|
[ ]0
|
0,10
|
|
—
|
—
|
|
[ ]reacciona
|
x
|
|
—
|
—
|
|
[ ]forma
|
—
|
|
x
|
x
|
|
[ ]eq
|
0,10 - x
|
|
x
|
x
|
- escribimos la expresión de Ka:
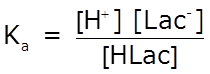
- reemplazamos las concentraciones en el equilibrio y determinamos x:
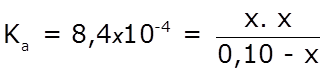
x2 + 8,4 x10–4x – 8,4 x10–5 = 0
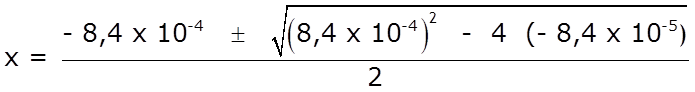
x1 = 8,75 x10–3 x2 = – 9,59 x10–3
- dado que el valor de x2 es negativo y x1 es menor que [HLac]0, elegimos el valor de x1 = 8,75 x10–3
- la concentración de iones H+ en el equilibrio será: [H+] = x = 8,75 x10–3 M
- el grado de ionización del ácido láctico será:
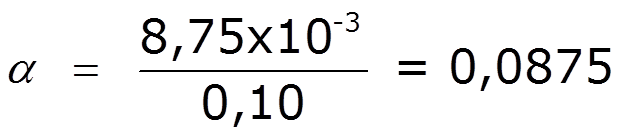
- el porcentaje de ionización será:
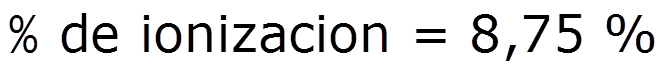
- finalmente determinamos el pH de la solución:
pH = – log [H+] = – log (8,75 x10–3) = 2,06
- hemos determinado que el pH de la leche agria es 2,06, es decir se trata de una solución ácida.
|