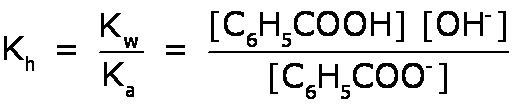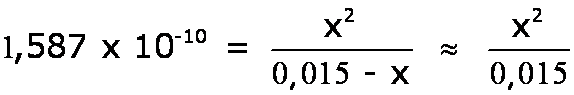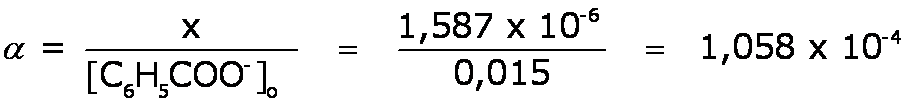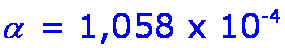3.6.6. Hidrólisis de sales
Como resultado de una reacción de neutralización entre un ácido y una base, se obtiene una sal, según la reacción general:
ácido + base → sal + agua
Una sal es un compuesto iónico que contiene un catión que no es H+ y un anión que no es OH–:
(catión de la base)(anión del ácido)
HCl + NaOH → NaCl + H2O
Cuando las sales se disuelven en agua se disocian completamente en sus iones, podríamos esperar que las disoluciones obtenidas fueran neutras, es decir con pH 7, sin embargo ¡¡esto no siempre es cierto!!
Hemos visto que hay dos tipos de ácidos y dos tipos de bases, los fuertes y los débiles, por consiguiente, las neutralizaciones ácido base van a conducir a cuatro tipos diferentes de sales.
Sales Provenientes de Ácidos y Bases Fuertes
El HCl es un ácido fuerte y el NaOH es una base fuerte que al reaccionar forman el cloruro de sodio, NaCl:
HCl + NaOH → NaCl + H2O neutralización ácido-base
ácido base sal agua
La disolución de este tipo de sales produce soluciones neutras:
NaCl(s) + H2O → Na+(ac) + Cl–(ac) ionización de la sal
 |
La disolución de una sal de este tipo no altera el equilibrio de disociación del agua, por lo tanto la solución es neutra: [H+] = [OH-] |
Sales Provenientes de Ácidos Débiles y Bases Fuertes
El HCN es un ácido débil y el NaOH es una base fuerte que al reaccionar forman el NaCN:
HCN(ac) + NaOH(ac) → NaCN(s) + H2O neutralización ácido-base
NaCN(s) + H2O → Na+(ac) + CN–(ac) ionización de la sal
Este tipo de sales se hidrolizan produciendo disoluciones básicas:
 hidrólisis de la sal
hidrólisis de la sal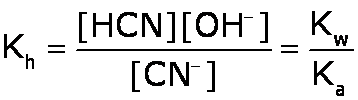
 |
El anión de la sal acepta un protón del agua, formando el ácido débil (del que proviene la sal), liberando iones hidroxilo, OH–, en consecuencia: [OH–] > [H3O+] pH > 7 |
Sales Provenientes de Ácidos Fuertes y Bases Débiles
El HCl es un ácido fuerte y el NH3 es una base débil que al reaccionar forman el NH4Cl:
HCl(ac) + NH3(ac) → NH4Cl(ac) neutralización ácido-base
NH4Cl(ac) → NH4+(ac) + Cl–(ac) ionización de la sal
Este tipo de sales se hidrolizan produciendo disoluciones ácidas:
 hidrólisis de la sal
hidrólisis de la sal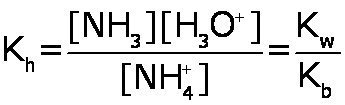
 |
El catión de la sal cede un protón al agua, formando la base débil (de la que proviene la sal), liberando iones hidronio, H3O+, en consecuencia:
[H3O+] > [OH–]
pH < 7
|
 |
Ejercicio Un preservante alimenticio es una sustancia que, sin alterar el sabor de los alimentos, impide el crecimiento de los microorganismos que los descomponen. Tal es el caso del benzoato de sodio, C6H5COONa, empleado en bebidas no alcohólicas como jugos, en margarinas y jaleas. La etiqueta de un envase de jugo de fruta indica que el contenido de benzoato de sodio es 0,015 M. Si sabemos que a 25 °C el Ka del ácido benzoico, C6H5COOH, es 6,3 x 10–5:
x = 1,587 x 10–6 [C6H5COO–] = 0,015 - x = 0,014998 M [C6H5COOH] = [OH–] = x = 1,587 x 10–6 M
pOH = – log [OH–] = – log (1,587 x 10–6) = 5,81 pH = 14 – pOH = 8,19
|
 |
Ejercicio Si la concentración del benzoato de sodio hubiera sido 0,10 M, analiza respecto a los valores obtenidos en el ejemplo anterior, en qué caso será mayor:
|