3.6.7. Efecto del ion común
En los tres procesos de disociación que hemos visto (de ácidos, bases y sales) hemos considerado un solo soluto cada vez. Analizaremos ahora el caso de disoluciones donde están presentes dos solutos que contienen un mismo ion (catión o anión), denominado ion común.
Los indicadores ácido-base son sustancias, generalmente coloreadas, que se disocian parcialmente. Sus iones presentan una coloración distinta a la de la especie sin disociar, de modo que, según el sentido que esté favorecido en el equilibrio, la disolución puede presentar uno u otro color de manera preferente. Conforme varía el pH de una solución, los indicadores varían su color, indicando de forma cualitativa, si la solución es ácida o básica.
Si a 100 mL de solución 0,10 M de un ácido débil, HA, se le añade el indicador anaranjado de metilo, éste presenta su color ácido, rojo:
HA + H2O  A– + H3O+ color del indicador: rojo
A– + H3O+ color del indicador: rojo
Si a esta solución se le añaden 0,015 moles de una sal de HA, por ejemplo NaA, el color cambia a amarillo:
HA + H2O  A– + H3O+ color del indicador: amarillo
A– + H3O+ color del indicador: amarillo
Esta observación experimental se puede explicar en base al Principio de Le Chatelier: la adición del ión A–, desplaza el equilibrio hacia la izquierda, y en consecuencia disminuye la concentración de los iones hidronio, H3O+, disminuyendo por lo tanto, el grado de disociación, alfa.
Dado que el ácido débil, HA, y su sal, NaA, tienen en común el ion A–:
HA(ac) + H2O(l)  A–(ac) + H3O+(ac)
A–(ac) + H3O+(ac)
NaA(ac) + H2O(l)  A–(ac) + Na+(ac)
A–(ac) + Na+(ac)
este fenómeno se denomina efecto del ion común.
 |
El efecto que puede ejercer la presencia de un ion común sobre un sistema en equilibrio, se basa en el Principio de Le Chatelier. |
Si analizamos el pH y el grado de disociación de 100 mL de una solución 0,10 M de ácido acético, CH3COOH, tendremos:
CH3COOH(ac) + H2O(l)  CH3COO–(ac) + H3O+(ac)
CH3COO–(ac) + H3O+(ac)
|
[ ]0 |
0,10 |
|
|
— |
— |
|
[ ]reacciona |
x |
|
|
— |
— |
|
[ ]forma |
— |
|
|
x |
x |
|
[ ]eq |
0,10 -x |
|
|
x |
x |

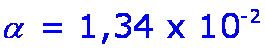
pH = 2,87
Si a esta solución de CH3COOH le añadimos 0,015 moles de acetato de sodio, CH3COONa, determinaremos la nueva concentración de los iones H3O+:
- La concentración de los iones acetato en la mezcla será:

- Dado que ion CH3COO– es uno de los productos de la disociación del CH3COOH, el equilibrio de éste se desplaza en el sentido inverso.
- Como vemos, será muy poco lo que se haya disociado del ácido acético, de modo que podemos considerar que la concentración inicial de éste sigue siendo 0,10 M.
- De igual manera, será muy poca la cantidad del ion acetato que se haya podido hidrolizar, por lo que consideraremos que su concentración sigue siendo 0,15 M.
- Al realizar el balance estequiométrico para el nuevo estado de equilibrio tendremos:
CH3COOH(ac) + H2O(l)  CH3COO–(ac) + H3O+(ac)
CH3COO–(ac) + H3O+(ac)
|
[ ]0 |
0,10 |
|
|
0,15 |
— |
|
[ ]reac. |
x |
|
|
— |
— |
|
[ ]forma |
— |
|
|
x |
x |
|
[ ]eq |
0,10 -x |
|
|
0,15 + x |
x |
- Como el Ka del ácido acético es 1,8 x 10–5, podemos determinar la nueva concentración de iones H3O+:
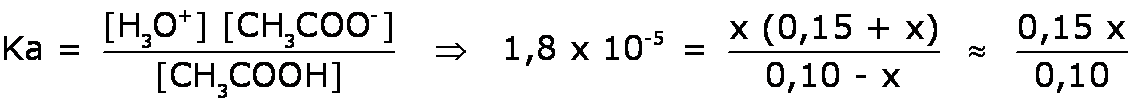
⇒ x = 1,2 x10–5 = [H3O+]
- El grado de ionización será:
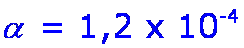
- Finalmente el pH de la disolución será: pH = - log [H3O+] = 4,92
 |
Hemos comprobado que al añadir el ion acetato disminuye la [H3O+], y por consiguiente, aumenta el pH de la solución, además disminuye el valor de alfa y en consecuencia, el grado de reacción. |
