4.2.1 Potenciales estándar de reducción
La diferencia de potencial entre el ánodo y el cátodo, se denomina potencial de celda E0celda y coincide con la FEM.
El potencial de celda, E0celda, de una celda galvánica siempre será positivo. Esto coincide con lo que deciamos en un prinicpio, la reacción redox debe ser una reacción es espontánea, para que se genere una celda galvánica.
Por ejemplo:
Zn(s) + Cu+2(ac) → Zn+2(ac) + Cu(s) E0(celda)= 1,10 V Reacción, espontánea
Cu(s) + 2H+(ac) → H2 (g) + Cu+2(ac) E0(celda)= - 0,344 Reacción, No espontánea
Queda claro, que el potencial de celda (E0celda), depende de las dos medias celdas: catódica y anódica.
E0Celda= E0oxidación - E0reducción
Por lo tanto, es necesario determinar el potencial de celda de cada uno de los electrodos. Sin embargo no se puede medir el potencial de un electrodo aislado. Para poder medir el potencial de un solo electrodo, se diseño el Electrodo Estándar de Hidrógeno (EEH).
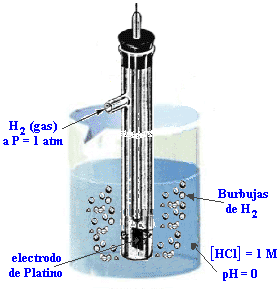
http://www.100ciaquimica.net/temas/tema9/punto6.htm
Un EEH se compone de un electrodo inerte de platino encerrado en un tubo de vidrio de modo que se pueda burbujear hidrógeno gaseoso sobre el platino, y la solución contiene H+ en condiciones estándar (1 M).
El electrodo estándar de hidrógeno, EEH, fuediseñado y se le asignó arbitrariamente el valor de potencial igual a cero, en el ocurre la siguiente reacción:
2H+(1M) + 2 e- → H2 (1 atm) E0(H+/H2) = 0,0 V
Se construyen las pilas voltaicas, donde uno de los electrodos es el EEH, de tal manera que la medida del E0celda, nos de el valor del otro elecvtrodo.
En la figura. se puede observar al EEH como compartimiento anódico:
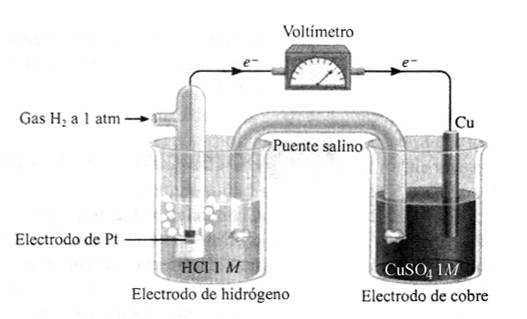
Notación abreviada:
Pt (s) / H2 (g, 1atm), H+ (ac, 1M) // Cu2+ (ac, 1M) / Cu (s)
Las medias reacciones serían:
Ánodo: H2(g) → 2H+(ac) + 2e- E0(oxidación) = 0,0V
Cátodo: Cu+2(ac) + 2 e- → Cu(s) E0 (reducción) = ???
Se mide el voltaje de la celda:
E0Celda= 0,34 V
Teniendo en cuenta que e E0 Celda = E0 oxidación + E0 reducción
Podemos concluir que el E0 de reducción, E0(Cu+2/ Cu) = 0,34 V
Ahora hagamos el análisis, colocando el EEH en el cátodo.
En la figura, se puede apreciar al EEH: como compartimiento catódico.
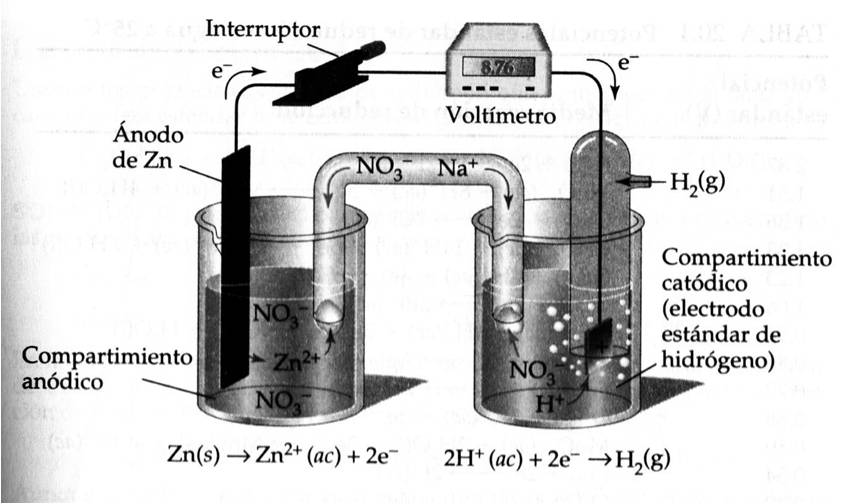
La celda voltaica, emplea un EEH y un electrodo estándar de Zn2+/Zn. La reacción espontánea es la oxidación del Zn y la reducción del H+:
Zn (s) + 2H+ (ac) → Zn2+ (ac) + H2 (g)
 |
Normalmente las tablas de potenciales estándar se reportan como E0reducción . Los valores E0oxidación tienen la misma magnitud, pero con signo contrario, y corresponden a la reacción inversa |
| Ejemplo: | 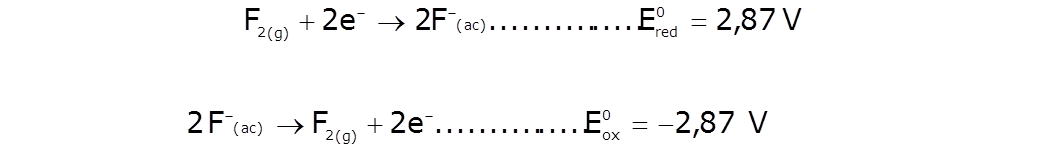 |
La siguiente tabla incluye algunos Potenciales Estándar de Reducción a 25ºC, a los que se les suele llamar potenciales de media celda, y se pueden combinar para calcular las fem de una gran variedad de celdas voltaicas.

 |
En el siguiente enlace, pueden encontrar, valores de potenciales estándar de reducción. http://profmokeur.ca/quimica/?var1=http://profmokeur.ca/quimica/potredoxsp.htm |
|
En el siguiente video se observa un problema sobre Diagrama de pila galvánica y potencial estándar |
Puesto que el potencial eléctrico mide energía potencial por carga eléctrica, los potenciales estándar de reducción son propiedades intensivas.
Por tanto, la modificación del coeficiente estequiométrico de una media reacción no afecta el valor del potencial estándar de reducción.
Por ejemplo, el Eored,
de la reducción de 2 moles de Zn2+ es el mismo que para la reducción de 1 mol de Zn2+:
2 Zn2+ (ac, 1 M) + 4e- → 2 Zn (s) Eored = - 0,76 V
Espontaneidad de las reacciones redox:
- Si el cálculo del voltaje para una reacción, es una cantidad positiva, la reacción puede ocurrir espontáneamente.
- Si es una cantidad negativa, la reacción no ocurre en el sentido propuesto. La reacción inversa sí será espontánea.
 |
Ejercicio Usando los potenciales estándar de reducción que se incluyen en la tabla (página 4-10) calcule la fem estándar de la celda que se describe. ¿Es espontánea la siguiente reacción? |
| Solución |
El primer paso para resolver este problema consiste en identificar las medias reacciones que se llevan a cabo en el ánodo y en el cátodo,
|
