4.3.1. Electrólisis de sales fundidas
Electrólisis de sales fundidas
- Las sales, por tratarse de compuestos iónicos, funden a altas temperaturas.
- Las sales en estado fundido tienen la capacidad de transportar corriente.
- Por ejemplo de sal que usamos en la cocina, NaCl(s), en el estado fundido estará como:
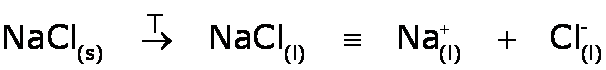
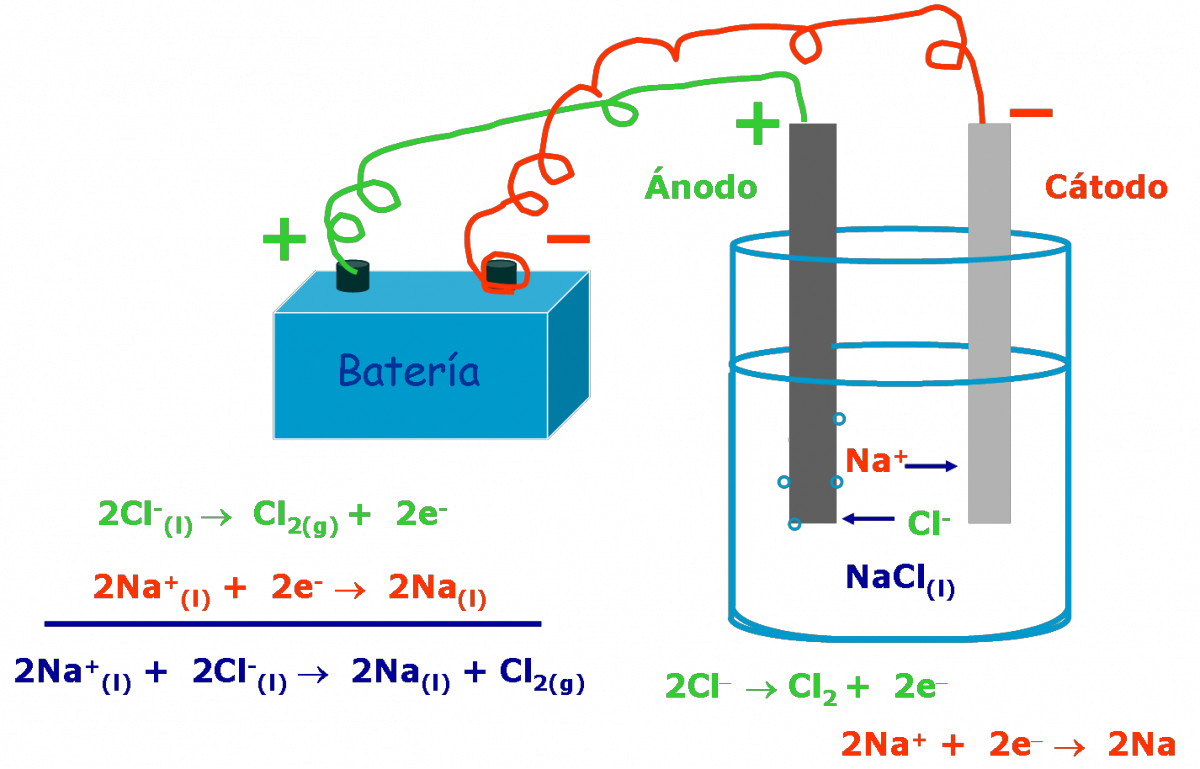
- Al pasar una corriente eléctrica, a traves de una sal fundida observaremos que:
- los cationes Na+ se desplazan hacia el cátodo donde se reducen.
- los aniones Cl– se desplazan hacia el ánodo donde se oxidan.
 |
Observación Al igual que las celdas galvánicas, el electrodo donde se produce la reducción se llama cátodo y el electrodo donde ocurre la oxidación es el ánodo. |
Así en el caso del NaCl fundido tenemos:
Cátodo: 2 Na+(l) + 2 e– → 2 Na(l)
Ánodo: 2 Cl–(l) → Cl2(g) + 2 e–
_________________________________
2 Na+(l) + 2 Cl–(l) → 2 Na(l) + Cl2(g)
 |
Importante La convención de signos para los electrodos de una celda electrolítica es opuesta a la correspondiente a las celdas galvánicas: el cátodo de la celda electrolítica es negativo porque los electrones están siendo forzados hacia él por la fuente externa de voltaje, mientras que el ánodo es positivo porque la fuente externa le esta quitando electrones. |
 |
Las electrólisis de sales fundidas aplicada en la producción de metales activos como el sodio, Na, y aluminio, Al, son procesos industriales importantes. |
El siguente video nos muestra una animación de lo que sucede durante el proceso de electrólísis del NaCl fundido:
