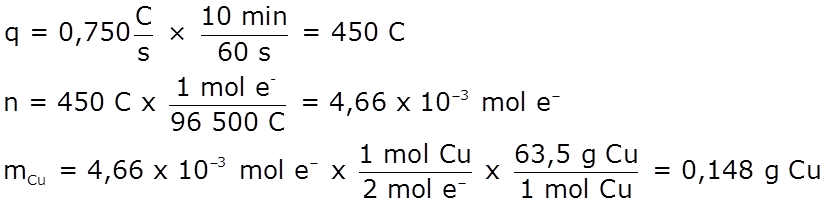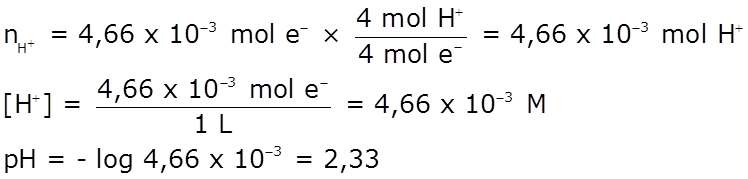4.3.4. Aspecto cuantitativo de la electrólisis
Aspecto cuantitativo
Según Faraday, la masa de un sustancia química, producto de la electrólisis, es directamente proporcional a la corriente que pasa a través de la celda.
En consecuencia, la cantidad de carga aplicada se determina por:
q = I x t
donde:
q = carga
I = intensidad de corriente
t = tiempo
Además:
- 1 Coulombio = 1 Ampere x segundo
- 1 mol de electrones transporta 96 500 Coulombios
- 1 F = 96 500 C = 1 mol de e-
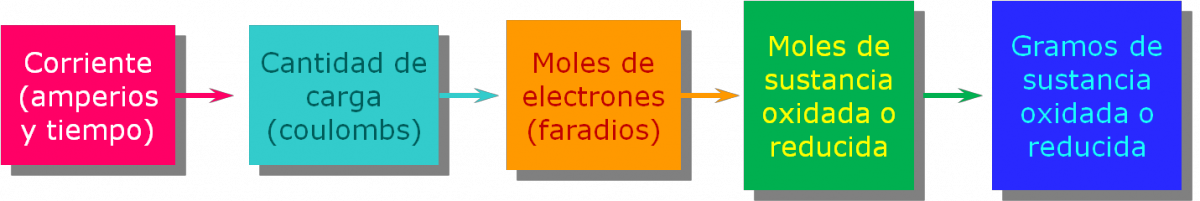
En consecuencia, podemos calcular el número de moles de electrones transportados por la cantidad de corriente suminstrada durante el tiempo de paso de la corriente aplicada.
A continuación se muestra la relación entre las cantidades de sustancias producidas o consumidas en la electrólisis y la cantidad de carga eléctrica que se utiliza. Son las mismas relaciones aplicables a las celdas galvánicas.
 |
Recuerda
|
 |
Problema Para la electrólisis de CuSO4:
Solución: ♦ Ánodo: oxidación del agua: 2 H2O(l) → O2(g) + 4 H+(ac) + 4 e– Cátodo: reducción del Cu2+: Cu2+(ac) + 2 e– → Cu(s)
|