4.4. Rendimiento de reacción
Si regresamos a la analogía de la producción de "panes con jamón", ahi veíamos que la fabricación de panes con jamón seguía la "ecuación" siguiente:
1 JAMÓN + 2 REBANADAS DE PAN → 1 “PAN CON JAMÓN”
Si le entregan a uno de los cocineros 18 jamones y 36 rodajas de pan, el puede preparar los panes con jamón, pero supongamos que se le caen 2 al piso y tiene que botarlos a la basura. Calcula el rendimiento de producción de panes con jamón que tuvo el cocinero.
Él debía conseguir una producción de 18 panes de jamón, "rendimiento teórico", pero en realidad solo puede entregar 16 panes de jamón, "rendimiento real".
El rendimiento de la reacción será:
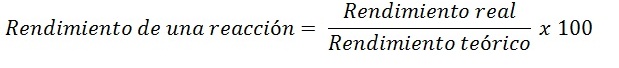
El rendimiento teórico de una reacción es la cantidad de producto que se “esperaría” obtener si todo funciona bien. Sin embargo, frecuentemente hay reacciones secundarias (formación de otros productos), o no todos los reactivos reaccionan como se esperaría. Esto ocasiona que no se alcance el rendimiento teórico sino una menor cantidad de producto: rendimiento real.
La relación entre lo que realmente (experimentalmente) se obtuvo de producto (rendimiento real) y el rendimiento teórico (lo que se esperaba obtener) es el rendimiento de la reacción. Ten en cuenta que el rendimiento se puede calcular en peso (gramos) o moles, teniendo cuidado que ambos rendimientos (real y teórico) estén en las mismas unidades.
 |
Ejercicio 4.3 La aspirina, C9H8O4, se produce a partir de ácido salicílico, C7H6O3, y anhidrido acético, C4H6O3, produciendo además ácido acético (C2H4O2). |
|
2.- ¿Cuánto ácido salicílico se requiere para producir 150 kg de aspirina, suponiendo que todo el ácido salicílico se convierte en aspirina? Recuerda que todo calculo estequiométrico debe hacerse en moles. 3.- ¿Cuánto ácido salicílico se requeriría si la reacción tiene un rendimiento de 80 %? Ten en cuenta que que se producen 150 kg (rendimiento real), debes averiguar cuanto es el rendimiento teórico, y con esta cantidad, calcular la cantidad de acido salicílico necesaria para esa producción, haciendo uso de las realciones estequiómetricas de la reacción. 4.- Calcula el rendimiento teórico de producción de aspirina, si se hacen reaccionar 185 kg de ácido salicílico con 125 kg de anhídrido acético. 5.- Si la situación descrita en la pregunta 4, produjera solo 182 kg de aspirina, calcula el porcentaje de rendimiento. |
|
 |
En el link que se da a continuación encontraras ejercicios sobre estequiometría: http://platea.pntic.mec.es/pmarti1/educacion/3_eso_materiales/b_v/ejercicios/bl_5_ap_4_01.htm |
