5.2. El estado gaseoso
Los gases intervienen en muchos aspectos de nuestra vida cotidiana, ya sea de manera positiva ayudándonos en nuestras labores, o de manera negativa perjudicando nuestro medio ambiente, así por ejemplo:
- el aire que respiramos, que nos proporciona el oxígeno que requerimos para respirar y mantenernos vivos,
- el GNV o gas natural vehicular, proveniente del gas de Camisea, que permite que los veículos se movilicen con una menor inversión en combustible,
- el gas propano que usamos en casa para preparar los alimentos o calentar el agua de la terma,
- el aire presente en las llantas de algunos vehículos,
- la mezcla gaseosa que se usan en las soldaduras, formada por acetileno combinado con oxígeno,
- el aire enriquecido que se emplea en submarinismo, son mezclas que además de oxígeno contienen helio, nitrógeno,
- los gases que se emanan junto con la lava en las erupciones volcánicas,
- los gases que se desprenden de los tubos de escape de los vehículos o de las chimeneas de las fábricas, y que contaminan nuestro ambiente.
 |
 |
 |
 |
| http://www.sxc.hu |
dalasa.obolog.com Google imágenes |
universalocean.es Google imágenes |
Google imágenes |
 |
 |
 |
|
biodisol.com Google imágenes |
planetark.org Google imágenes |
volcanoes.usgs.gov Google imágenes |
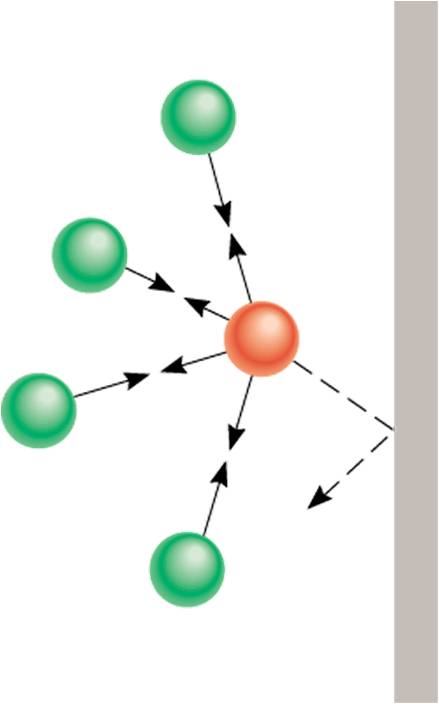
Las características que define a los gases son:
- pueden ser confinados en un recipiente, ocupando todo el volumen del que disponen y adquiriendo la forma del recipiente que los contiene,
- son altamente compresibles,
- se combinan fácilmente cuando varios gases se confinan en un mismo recipiente,
- sus densidades son mucho menores que las de los sólidos y los liquidos;
esto es debido a que la distancia entre las moléculas es mucho más grande que en el estado líquido o en el estado sólido y, porque las moléculas se encuentran en constante movimiento.
Son cuatro los parámetros que definen el comportamiento de las sustancias en el estado gaseoso: la presión, P, el volumen, V, la temperatura, T y la cantidad de sustancia en estudio, n. Todos estos parámetros están relacionados entre sí en base a las teorías de los gases ideales.
Se consideran gases a aquellas sustancias que a condiciones normales, existen naturalmente en el estado gaseoso, mientra que cuando una sustancia, líquido o sólido, se evapora, se dice que se encuentra en fase gas. En la siguiente tabla se muestran algunos gases y sus propiedades.
|
Nombre |
Fórmula |
Color |
Olor |
Toxicidad |
|---|---|---|---|---|
|
Amoníaco |
NH3 |
Incoloro |
Penetrante |
Tóxico |
|
Dióxido de carbono |
CO2 |
Incoloro |
Inodoro |
No tóxico |
|
Monóxido de carbono |
CO |
Incoloro |
Inodoro |
Muy tóxico |
|
Cloro |
Cl2 |
Verde pálido |
Irritante |
Muy tóxico |
|
Helio |
He |
Incoloro |
Inodoro |
No tóxico |
|
Neón |
Ne |
Incoloro |
Inodoro |
No tóxico |
|
Hidrógeno |
H2 |
Incoloro |
Inodoro |
No tóxico |
|
Cloruro de hidrógeno |
HCl |
Inodoro |
Irritante |
Tóxico |
|
Sulfuro de hidrógeno |
H2S |
Incoloro |
Fétido |
Muy tóxico |
|
Metano |
CH4 |
Incoloro |
Inodoro |
No tóxico |
|
Nitrógeno |
N2 |
Incoloro |
Inodoro |
No tóxico |
|
Dióxido de nitrógeno |
NO2 |
Marrón rojizo |
Irritante |
Muy tóxico |
|
Oxígeno |
O2 |
Incoloro |
Inodoro |
No tóxico |
 |
Observación La atmósfera terrestre consiste de una mezcla de gases que rodea la Tierra, se mantiene sobre ella gracias a la acción de la gravedad y como es materia, ejerce presión sobre la superficie terrestre. Este hecho fue demostrado por Evangelista Torricelli (1606 - 1647); para ver una breve explicación del experimento puedes pulsar aquí. En el siguiente video puedes evidenciar el efecto de la presión atmosférica: |
 |
¿Sabes ...
|
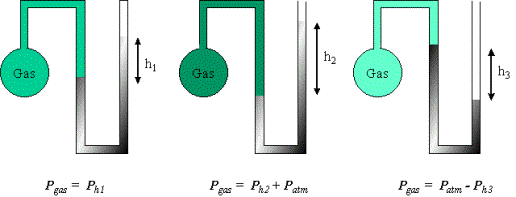
Para medir la presión de un gas que se encuentra dentro de un recipiente se usan generalmente manómetros de mercurio, Hg, como se muestran en la figura y que operan de la siguiente manera: