5.2.2. Mezcla de gases - Ley de Dalton
El estudio de las mezclas gaseosas tiene tanta importancia como el de los gases puros. Por ejemplo, el aire seco es una mezcla de 78,1 % (en volumen) de nitrógeno, N2; 20,9 % de oxígeno, O2; y 0,9 % de argón, Ar; el 0,1 % restante es principalmente dióxido de carbono, CO2. Las mezclas de gases son sumamente importantes en la industria, por ejemplo, aquellas en las que se requiere O2 o N2, usan directamente el aire.
- Presión parcial, p, es la presión que ejerce cada gas dentro de una mezcla gaseosa.
- Fracción molar, x, de cada componente en la mezcla, es la fracción del número de moles de un determinado componente respecto al número total de moles de todos los componentes de la mezcla.
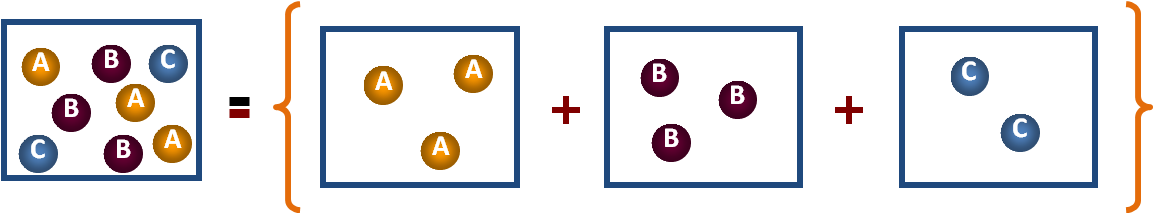
- El primer recipiente, con un volumen V, contiene 3 moléculas del gas A, 3 del gas B y 2 del gas C. Como son gases, se encuentran en una mezcla homogénea.
- Luego se muestra 3 recipientes del mismo volumen V, conteniendo cada uno, un solo tipo de gas.
- Cada uno de los recipientes puede ser caracterizado por su presión, P, el número de moles, n, y el volumen, V, siendo éste constante en los 4 casos.
 |
|||||
| V nT PT | V nA pA | V nB pB | V nC pC | ||
|
PTV = nTRT |
pAV = nART | pBV = nBRT | pCV = nCRT | ||
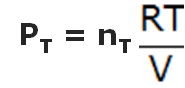 |
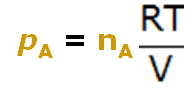 |
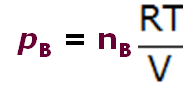 |
 |
||
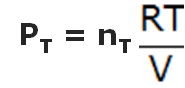 |
 |
||||
Para el caso analizado podemos concluir que:
PTotal = pA + pB + pC
nTotal = nA + nB + nC
Ley de Dalton
La presión total, P, de una mezcla de gases (que no reacciona entre si) es igual a la suma de las presiones parciales, pi, de los gases individuales que participan.
La presion parcial, pi, se define como la presión que ejercería cada gas i, si se encontrase sólo en el mismo recipiente y a la mismas temperatura.
Si dividimos entre si las siguientes espresiones:
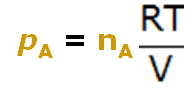
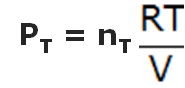
obtenemos la siguiente expresión:
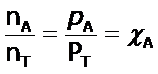
Donde 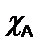 se denomina la fracción molar (que también puede expresarse en términos de presiones). Conocida la fracción molar del gas A, se puede determinar su presión parcial:
se denomina la fracción molar (que también puede expresarse en términos de presiones). Conocida la fracción molar del gas A, se puede determinar su presión parcial:
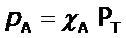
Se debe tener en cuenta que se cumple:
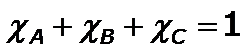
 |
Ejercicio
En un balón de 5,0 L, se tiene una muestra que contiene 2,43 moles de nitrógeno y 3,07 moles de oxígeno, a 298 K. Determina:
a) la presión parcial de cada gas en el recipiente.
b) la presión total de los gases en el balón.
a)
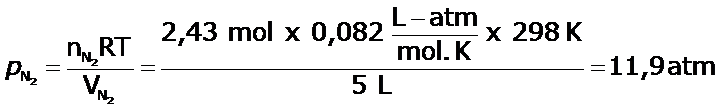 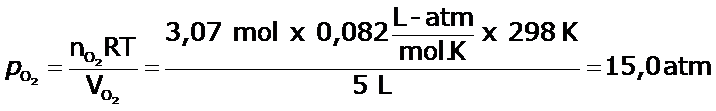 b)
 |
