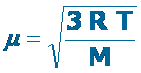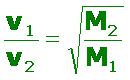5.2.3. Teoría Cinético Molecular - Ley de Graham
Teoría Cinético Molecular
El estudio del comportamiento de los gases está basado en las leyes estudiadas previamente y se explica mediante la teoría cinético molecular, la cual fue enunciada por el físico alemán Rudolf Clausius, que establece lo siguiente:
- Los gases están formados por partículas muy pequeñas llamadas moléculas. Las distancias entre ellas son muy grandes, en comparación con sus diámetros, de modo que se considera que las moléculas poseen masa pero tienen volumen despreciable.
- Las moléculas de un gas se mueven constantemente, en todas direcciones y al azar, además los choques o colisiones son elásticos. No todas las moléculas se mueven con la misma velocidad, las cuales son muy altas. Por ejemplo, la velocidad media de una molécula de hidrógeno, H2, a 25 °C es de 1768 m.s-1, casi 6400 km/hora. En consecuencia, poseen energía cinética, Ec:
EC = ½ m υ2
donde: m es la masa de la molécula gaseosa
υ es la velocidad promedio con la que se desplaza
- No existen fuerzas de atracción ni repulsión entre las moléculas de un gas ideal, ni entre éstas y su recipiente. Por lo tanto, cuando una molécula choca contra otra, la energía se transfiere de una a otra pero la energía total de todas las moléculas permanece sin cambio.
- La energía cinética de las moléculas es proporcional a la temperatura del gas, en grados Kelvin. Dos gases cualesquiera a la misma temperatura, tendrán la misma energía cinética.
 |
Observaciones
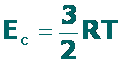 donde: R es la constante de los gases ideales
T es la temperatura absoluta
donde: R es la constante de lso gases ideales T es la temperatura absoluta M es la masa molar del gas En consecuencia, a una misma temperatura, las moléculas más pesadas, tendrán menor velocidad cuadrática media.
|
 |
Ejercicio En base a lo planteado por la teoría cinético molecular, cómo explicarías:
|
 |
Observación Has notado que cuando en casa usan un aromatizador, éste se esparce y se "siente" o puedes olerlo a cierta distancia, al cabo de unos segundos, ¿verdad? Recordarás también que cuando niño, te regalaban un globo, sea lleno de aire o de helio, jugabas con él y luego lo guardabas unos días, ¿qué le pasaba ... se "achicaba", verdad? ¿Cómo se explican estos hechos? |