5.3. Fuerzas intermoleculares
- Ya hemos visto sobre las propiedades y el comportamiento de los gases pero. Sabemos que se pueden condensar al estado líquido, bajando la temperatura o aumentando su presión.
- Según la teoría cinético molecular todo gas al disminuir la temperatura, reduce su velocidad promedio de movimiento y al aumentar la presión, se hace que las moléculas se acerquen más unas a otras.
- Luego, al estar más próximas y moverse con mayor lentitud, se atraen entre sí, "enlazándose" y formando una gota.
- Si la temperatura del líquido siguiera bajando, la velocidad seguiría disminuyendo. A temperaturas suficientemente bajas, las moléculas ya no tienen energía suficiente para moverse, entonces se juntan entre sí, formando un sólido.
Para entender por qué las moléculas de un gas enfriado se convierten en un líquido, debemos considerar la naturaleza de estas fuerzas de atracción entre las moléculas (y átomos).
- Las atracciones entre moléculas se llaman Fuerzas Intermoleculares. Existen otros tipos de atracciones llamadas intramoleculares que son las fuerzas responsables de la unión de los átomos dentro de una molécula, (ésto nos recuerda términos que ya conocemos, como internet e intranet).
- Las fuerzas intermoleculares no son tan fuertes como las fuerzas intramoleculares, así por ejemplo, se requieren 41 kJ para vaporizar un 1 mol de agua (inter) y 930 kJ para romper todos los enlaces O-H en 1 mol de agua (intra).
- La intensidad de las fuerzas intermoleculares disminuye drásticamente al aumentar la distancia entre las moléculas, por ello en los gases no tienen tanta importancia.
- Muchas propiedades de los líquidos, incluido su punto de ebullición, reflejan la intensidad de las fuerzas intermoleculares.
- Fuerzas de dispersión de London
- Fuerzas dipolo - dipolo
- Fuerzas de puente de hidrógeno (enlace de hidrógeno)
 |
El orden de magnitud relativa de las fuerzas intermoleculares es:
enlace de hidrógeno > dipolo – dipolo > dispersión de London |
 |
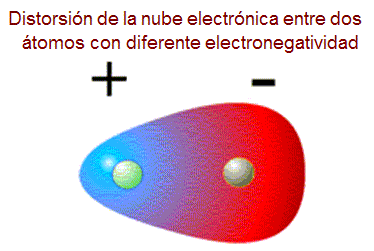
Dipolo: se forma cuando los centros de carga no coinciden, están separados, pero no forman cargas aisladas:
Tomado de http://www.ehu.es/biomoleculas/
Las moléculas polares forman dipolos, por ejemplo el etanol, CH3CH2OH:
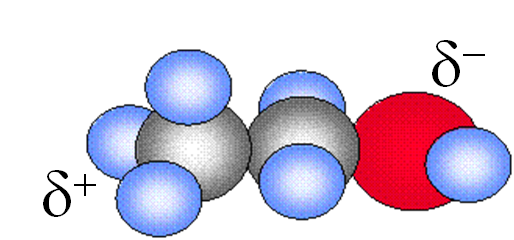 Momento dipolar: la magnitud del momento dipolar se incrementa al aumentar las cargas y la distancia de separación de éstas.
Para más información puedes visitar "momento dipolar" aqui.
|
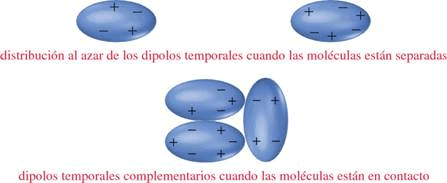
- ¿Pueden existir fuerzas intermoleculares entre moléculas no polares?
- Si experimentalmente se consigue licuar los gases no polares, entonces, ¿qué fuerzas son las que actúan sobre las moléculas no polares? Debe existir alguna fuerza que produzca la suficiente atracción para que las moléculas se mantengan unidas entre sí en el estado líquido.
- ¿Qué fuerzas pueden existir entre átomos y moléculas no polares?
 |
Se denomina polarizabilidad, a la facilidad con que la distribución electrónica de un átomo o molécula, puede distorsionarse por acción de un campo eléctrico externo. |


 |
La polarizabilidad se incrementa cuando:
Es decir las moléculas y átomos de mayor peso molecular, son más polarizables. Los dipolos formados por las fuerzas de London, en moléculas apolares, existen en forma momentánea, cambiando rápidamente de magnitud y de dirección.
|
 |
Las fuerzas de dispersión de London están presentes en todas las moléculas, sean polares o apolares. |
Fuerzas dipolo - dipolo
- Interacción electrostática de dos moléculas polares, (dipolos):

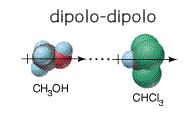
- Interacción de muchos dipolos:

 |
|
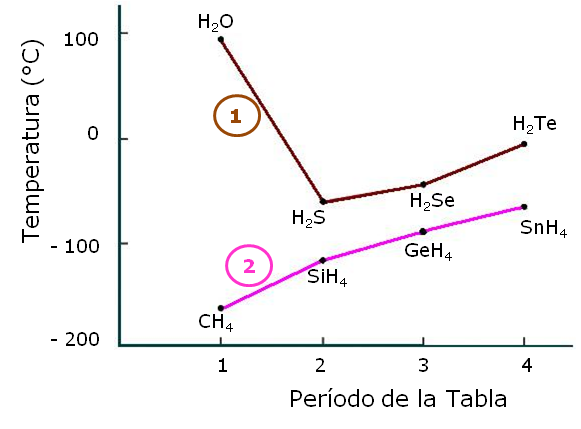
- en la curva 2 se mantiene la tendencia de que conforme se incrementa la masa molar, aumenta el punto de ebullición,
- en la curva 2 sin embargo, se observa una excepción de la regla, en el caso del agua.
¿Por qué el agua es la excepción a la regla?
 |
El enlace o puente de hidrógeno, es una interacción dipolo-dipolo especial entre:
|
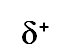 y
y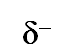
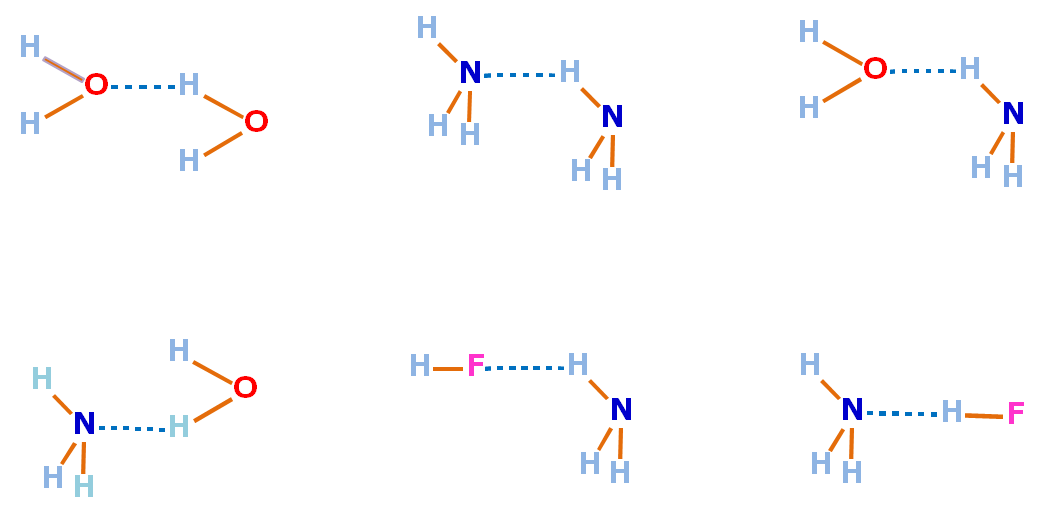
 |
Las fuerzas del enlace de hidrógeno son más débiles que las debidas a los enlaces químicos, pero son mayores que las otras fuerzas intermoleculares. |
 |
Ejercicio Luego de observar el siguiente video, explica brevemente por qué el hielo (agua sólida) posee menor densidad que el agua líquida. |
 |
Enlaces Si deseas más información sobre el enlace de hidrógeno, puedes visitar: http://www.ehu.es/biomoleculas/moleculas/fuerzas.htm#fu511 http://www.visionlearning.com/library/modulo_espanol.php?mid=57&l=s&c3= |
 |
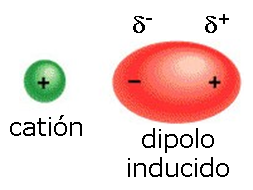
Para que exista una fuerza ion-dipolo, necesariamente deben estar presentes:
|
Las moléculas polares son dipolos, donde las cargas negativas y positivas no coinciden en un punto central, por ello la orientación preferida de las moléculas polares hacia los iones es:
|
Tomado de http://blog.espol.edu.ec/ldomingu/quimica/ capitulo-v/ |
|
 |
La magnitud de la atracción es mayor:
|
 |
Enlace Puedes visualizar una simulación de cómo interactúan los dipolos del agua con el compuesto iónico cloruro de sodio, NaCl, si visitas esta página. |