5.6. Cambios de estado - Diagramas de calentamiento - Diagramas de fase
Cambios de estado
Hemos visto que en los diferentes estados que presenta la materia, la intensidad de las fuerzas intermoleculares es diferente, lo cual le confiere distintas características a cada estado, como se resume en el siguiente video:
Piensa ahora en lo siguiente:
 |
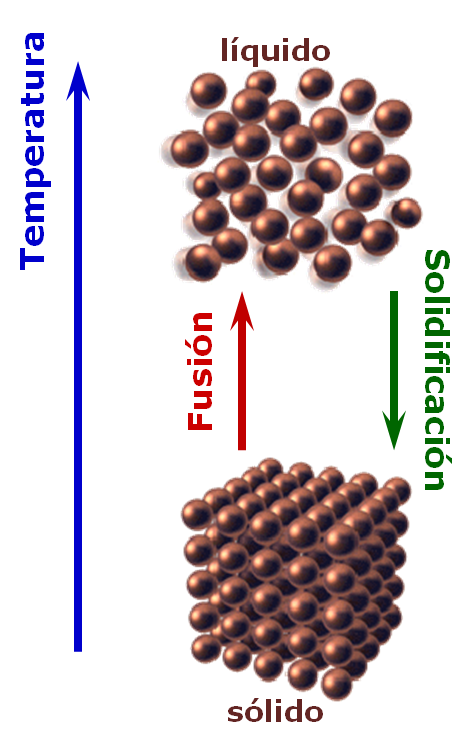
Retiras del congelador, unos cubos de hielo, H2O(s), para colocarlos en tu refresco, pero en ése momento dos de tus amigos tocan el timbre, sales a ver y te quedas conversando con ellos ...... ¿qué habrá pasado cuando regresas?, ¿qué encuentras?, ¿por qué se "derritió" (el término apropiado es "se fundió") el hielo?, ¿este proceso necesitó o liberó calor? |
 |
Una fría noche de invierno, tus compañeros y tú están estudiando en tu casa, por lo que pones a hervir un poco de agua, H2O(l), para que puedan servirse una reparadora taza de café. Mientras que el agua hierve o "ebulle", ¿qué observas?, ¿qué es ese "humo" (el término es "vapor") que observas que sale del envase?, ¿por qué se forman esas burbujas que ascienden desde el fonda hasta la superficie?, ¿de qué son? Evidentemente proporcionaste calor para que se produzca el proceso de la ebullición. |
 |
Conoces el "hielo seco", CO2(s), aquel que usan por ejemplo, los heladeros en las carretillas, para mantener la temperatura que necesitan para preservar en buen estado sus productos. Cuando un trozo de hielo seco se deja a la intemperie, se observa lo mostrado en la figura de la izquierda. Se ve una especie de "humo" que se desprende de él, ¿qué es?, al cabo de cierto tiempo, todo el hielo seco "desaparece" sin dejar "huella". Lo que ha ocurrido es una sublimación, ¿el proceso necesitó o liberó calor? |
Podemos establecer que: los cambios de fase, o las transformaciones de una fase a otra, ocurren cuando a una sustancia se le agrega o se le quita energía (en general, en forma de calor).
Equilibrio líquido - vapor
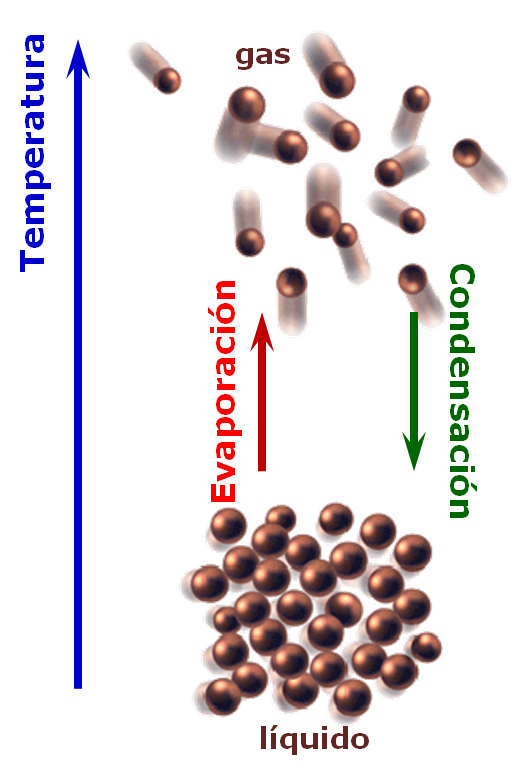
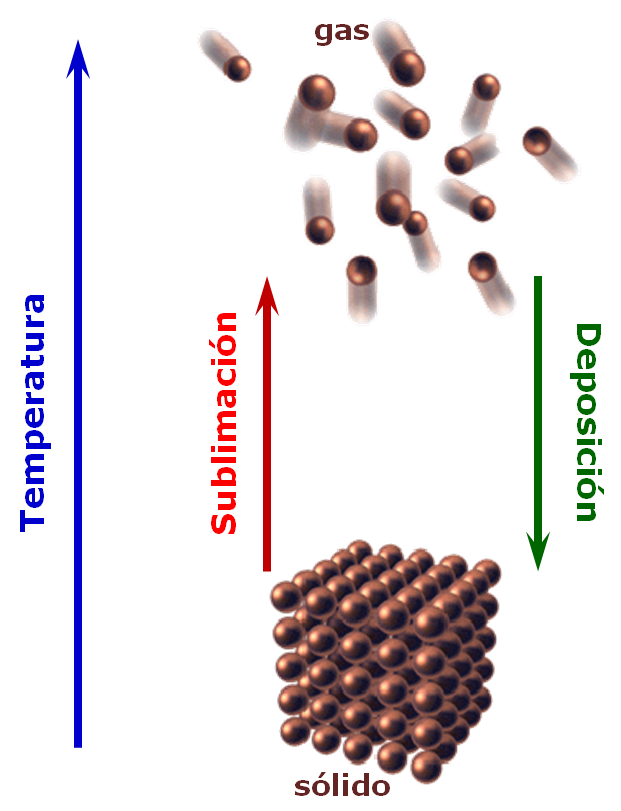
Los cambios de fase son cambios físicos que se caracterizan por variaciones en el orden molecular; las moléculas de la fase sólida tienen mayor ordenamiento mientras que en la fase gas, mayor desorden.
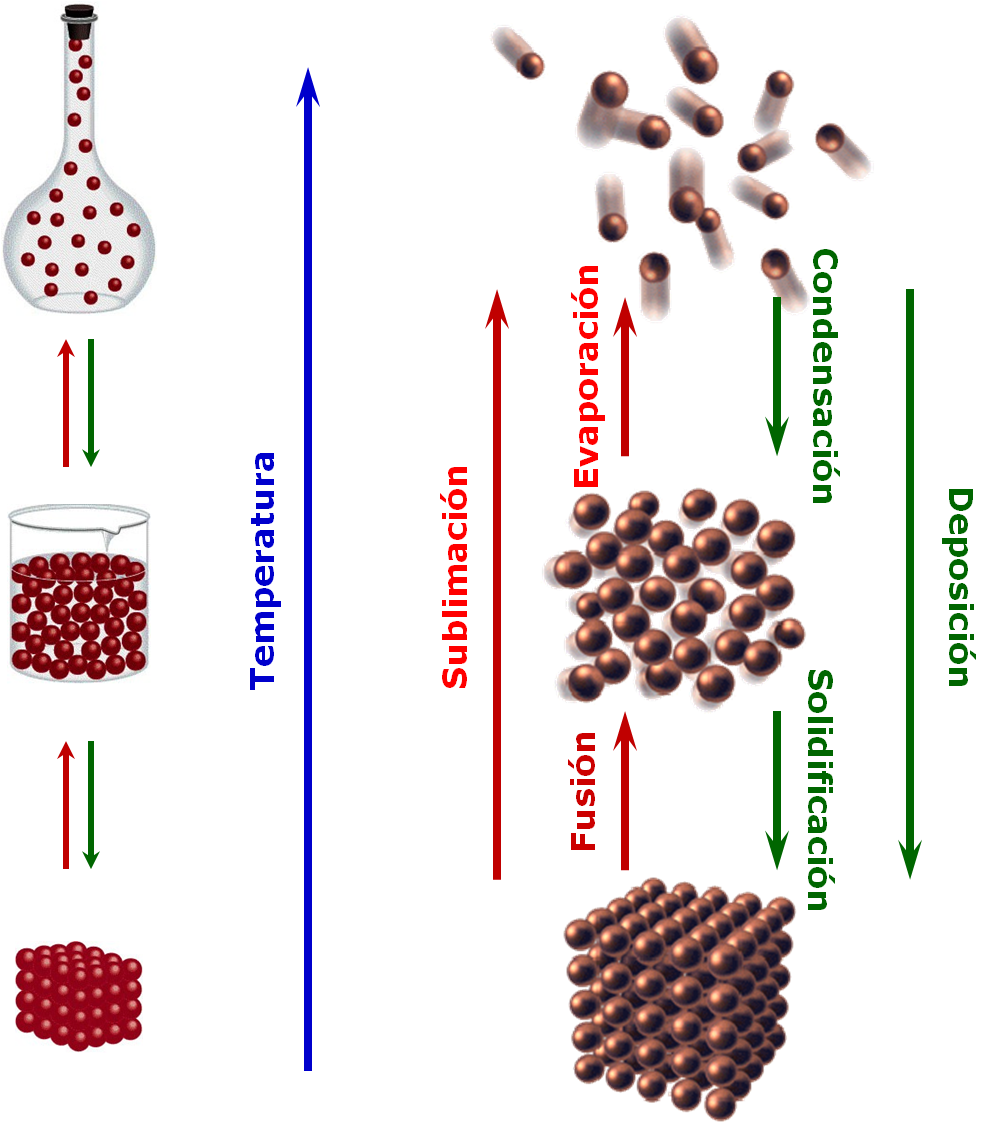
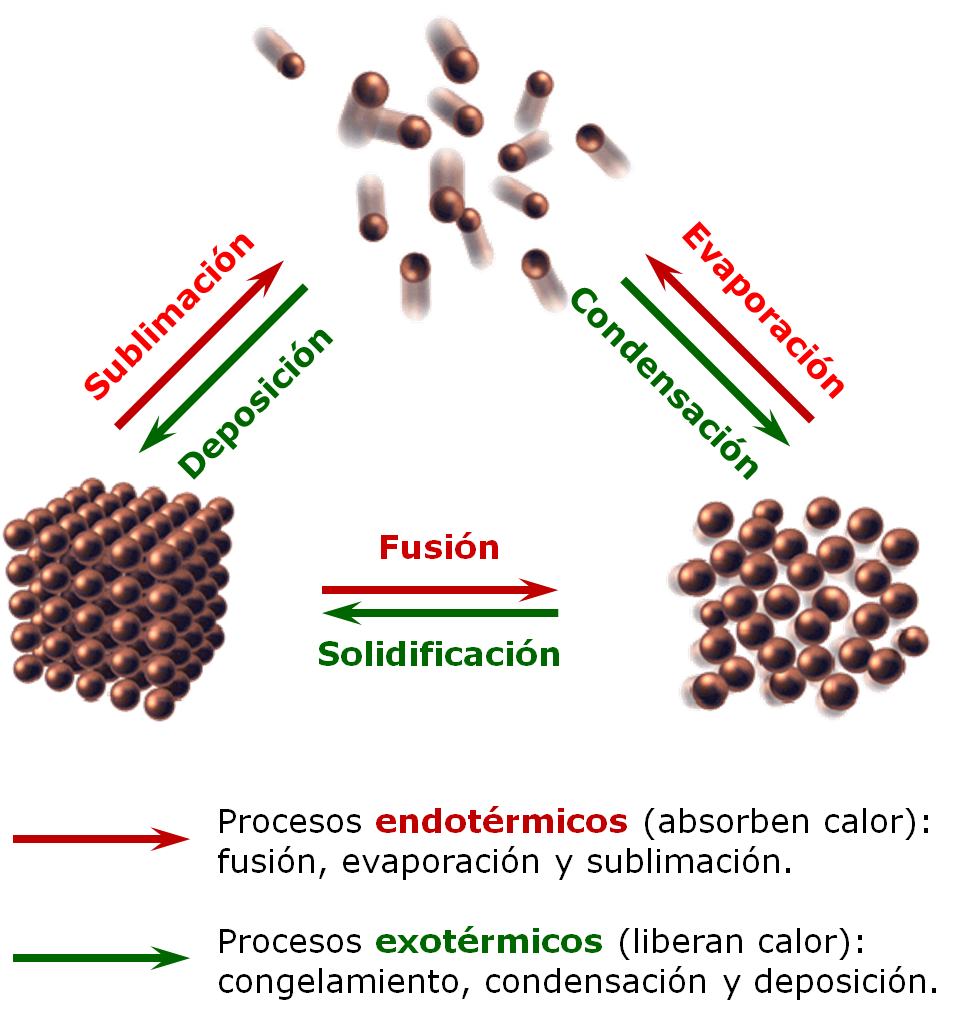
 |
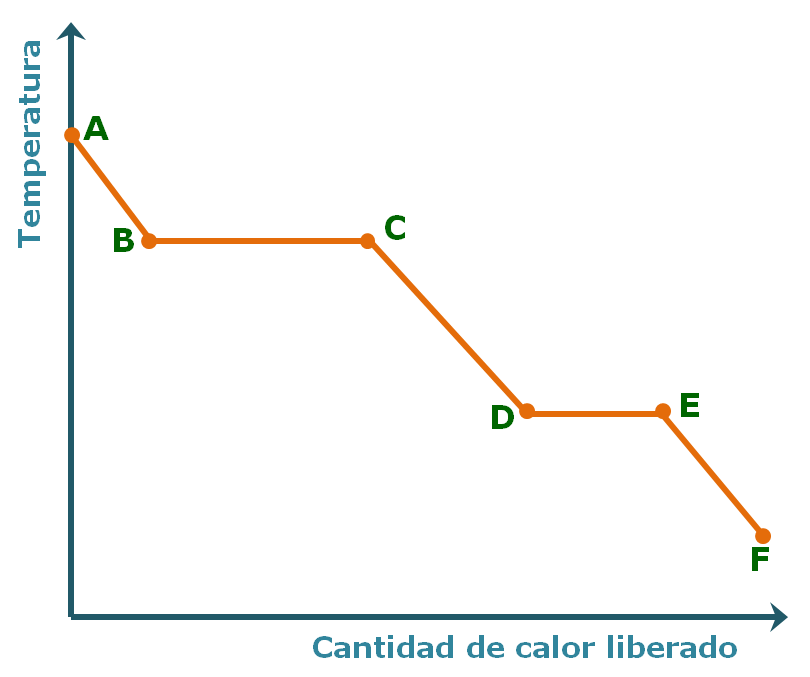
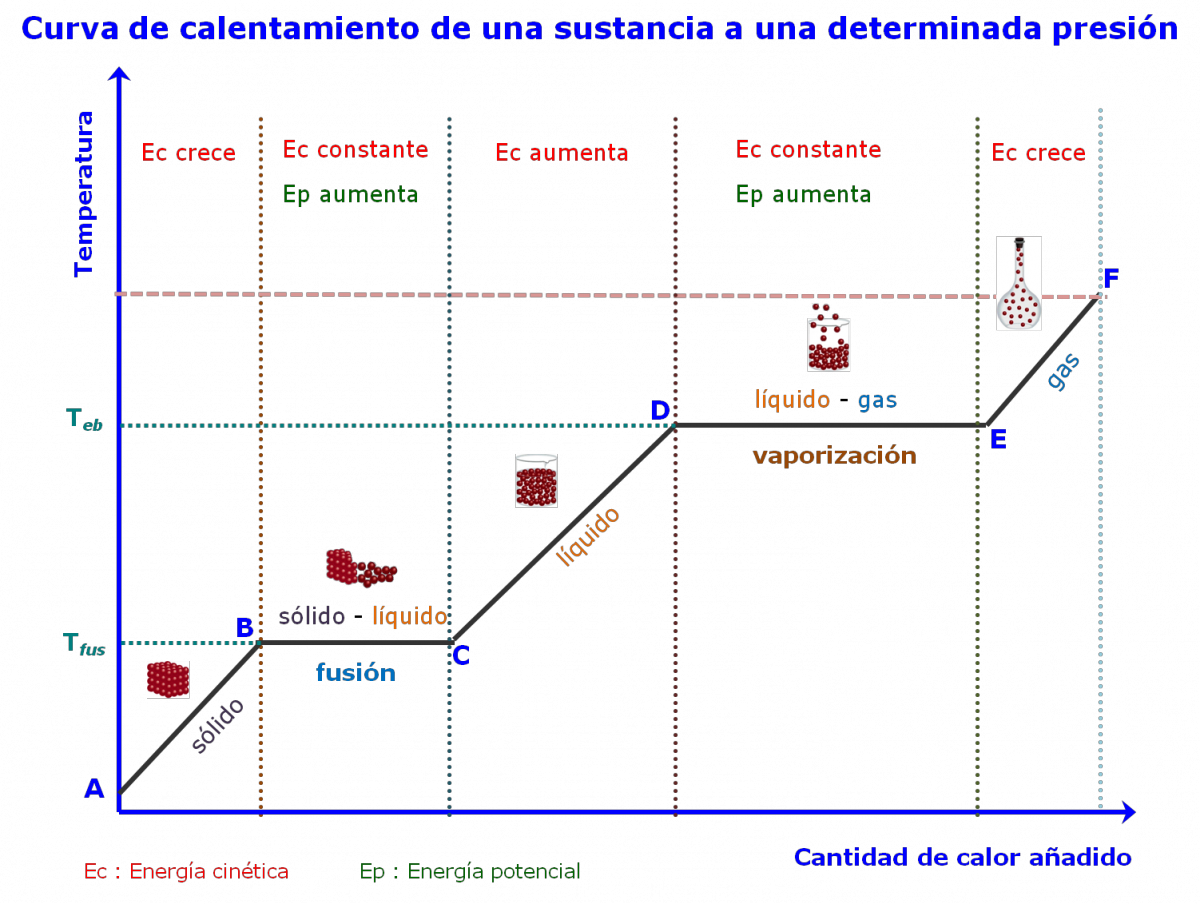
Observaciones En los cambios de fase, a pesar de aumentar la cantidad del calor añadido, no hay un aumento de la temperatura. La cantidad de calor que se absorbe durante la evaporación es mayor que el calor absorbido durante la fusión. ¿Por qué? |
En el siguiente video puedes apreciar una simulación de lo que ocurre a nivel molecular, cuando se calienta una sustancia, a determinada presión:
 |
Ejercicio Si en lugar de calentar la sustancia sólida, una cierta masa de gas, a determinada presión, se somete a un enfrimiento paulatino, el gráfico que se obtiene se denomina diagrama de enfriamiento,
|
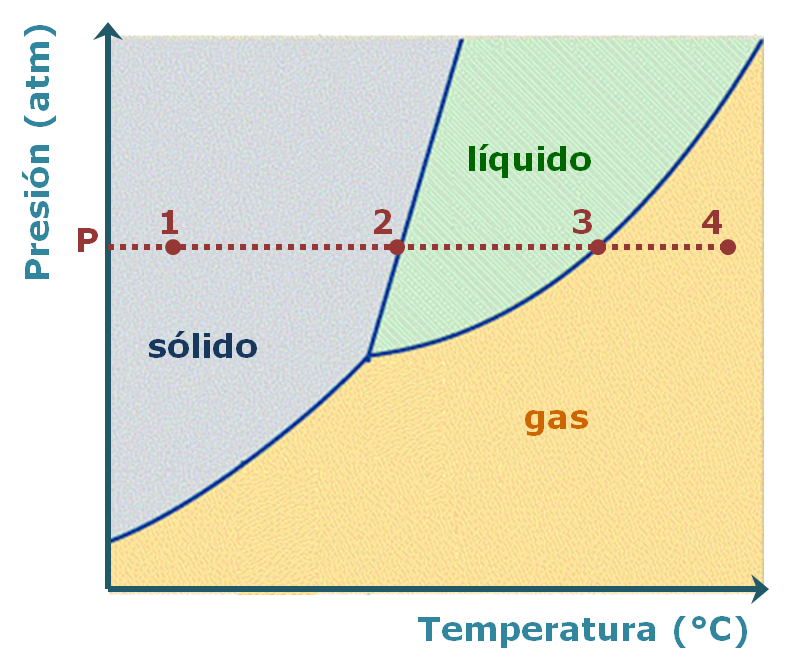
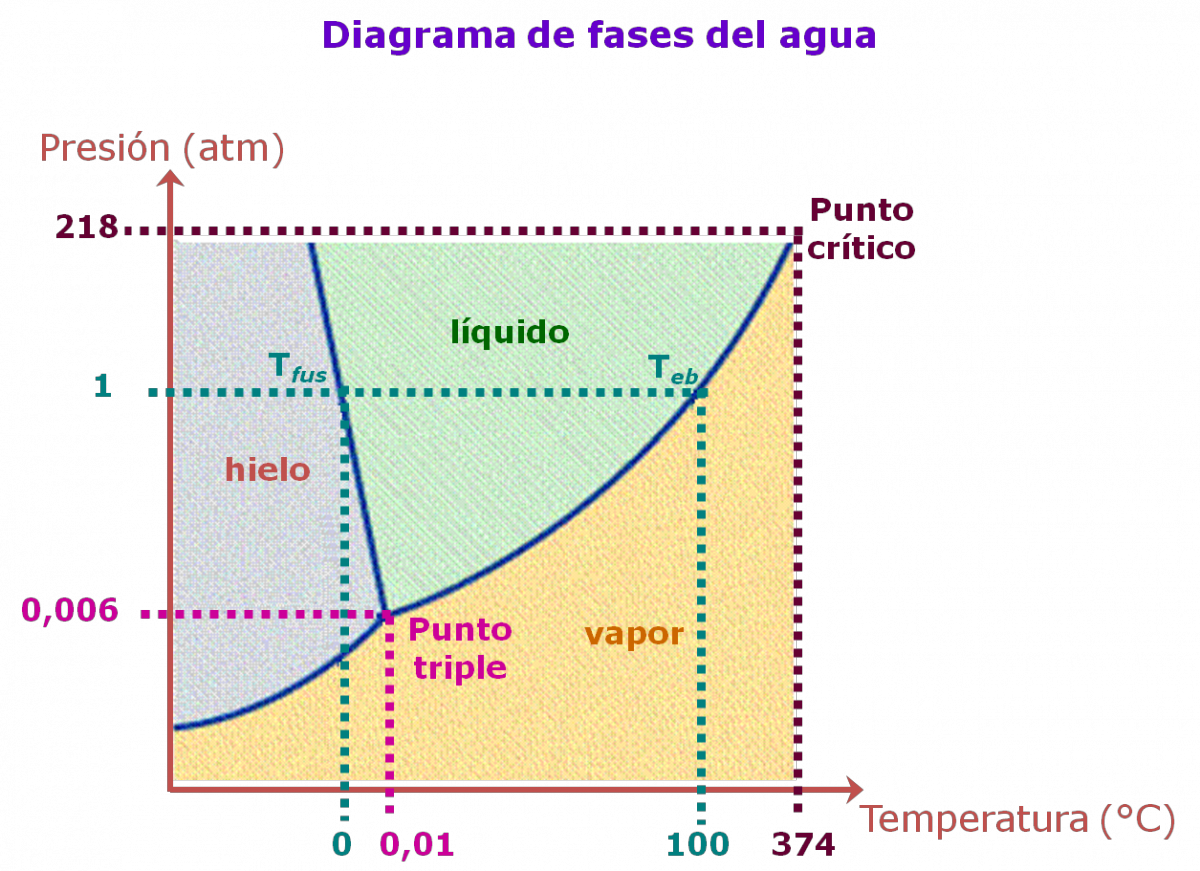
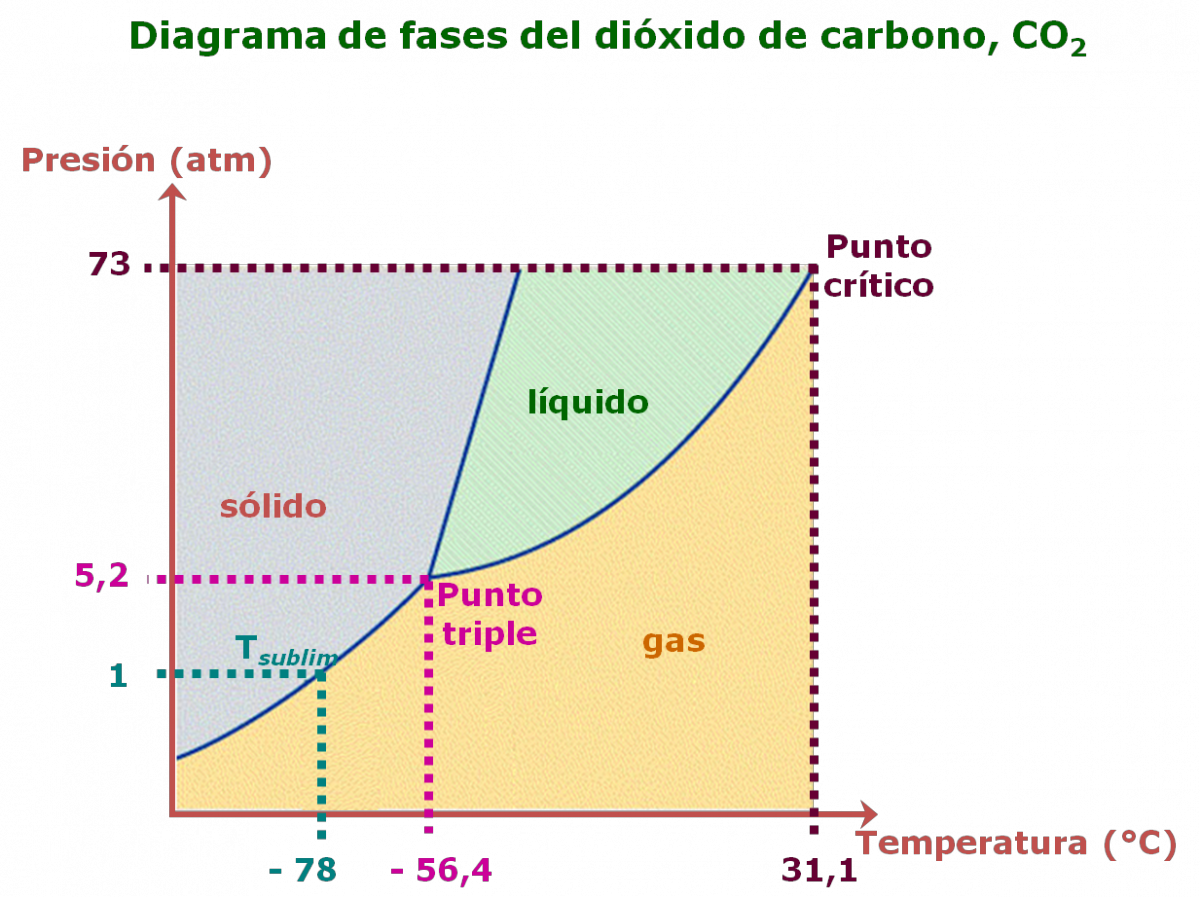
- Es un diagrama presión versus temperatura.
- Presenta un punto triple, A, donde las tres fases sólido, líquido y gas se encuentran en equilibrio.
- Presenta un punto crítico, B, que es el extremo de la curva de presión de vapor. La temperatura en este punto se llama temperatura crítica y la presión se denomina presión crítica. A temperaturas mayores a la temperatura crítica una sustancia no se puede licuar (pasar de gas a líquido), independientemente de lo elevada que sea la presión.

Los diagramas de fase permiten predecir los cambios de punto de fusión, punto de ebullición y punto de sublimación de una sustancia, debido a las variaciones de la presión externa.
 |
Observaciones
En los diagramas de fase mostrados, existe una gran diferencia en la pendiente de la curva entre las fases sólida y líquida: en el caso del agua es negativa, mientras que en el del CO2 (como la mayoría de las sustancias) es positiva.
El agua se comporta de manera excepcional porque el hielo es menos denso que el agua líquida: cualquier muestra de agua en forma de hielo ocupa un volumen mayor que el que ocupa como agua líquida, debido al gran espacio vacío, originado por la formación de los puentes de hidrógeno.
|
En el siguiente video puedes observar la presencia del punto triple en el alcohol ter-butílico:
 |
Ejercicio Analiza cada uno de los diagramas de fase, del agua y del dióxido de carbono, y completa la siguiente tabla:
|
||||||||||||||||||||||||||||||||||
 |
Ejercicios Explica brevemente las siguientes observaciones:
Por qué cuando añades cubos de hielo a un vaso de agua, refresco o gaseosa, o cuando sacas tu gaseosa de la refrigeradora, se forman gotas en las paredes externas del recipiente.
Por qué cuando hierve agua en un recipiente tapado, en el momento de la ebullición, "baila" la tapa. |
 |
Ejercicio Observa los dos diagramas que se muestran a continuación y:
|