6.1. La atmósfera de la tierra y la calidad del agua
La vida en la tierra forma parte de un gran sistema encadenado: necesitamos una atmósfera para respirar, agua para hidratarnos y un suelo fértil que nos proporcione alimentos. Los seres vivos dependen totalmente de este gran sistema. Sin embargo, el desarrollo y el ritmo de vida actuales ponen en peligro este sistema: la calidad del aire, agua y suelo empeora día a día debido a nuestras actividades cotidianas y a las industrias.
A menos que usemos los recursos de la tierra de manera sostenible y prudente, el futuro aparece incierto: problemas como el calentamiento global, la capa de ozono, la falta de agua y la contaminación suenan cada vez con más fuerza por todo el mundo.
LA ATMÓSFERA
Nuestro planeta está envuelto por una delgada capa gaseosa sujeta a la superficie gracias a la gravedad y al peso, claro, de las moléculas de gas. El espesor de la atmósfera es de unos mil kilómetros. La densidad de los gases desciende rápidamente con la altura: la mitad de la masa de la atmósfera se encuentra en los primeros cinco kilómetros y a unos cincuenta kilómetros de altura se puede decir que estamos casi en el vacío (sin aire). La atmósfera se presenta en capas, las cuales tienen temperaturas bastante estables, que actúan como protectores: nos protegen de la radiación que recibe la tierra y, a su vez, controlan la radiación que sale de nuestro planeta.
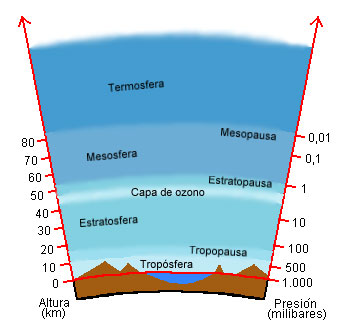
Figura 6.1. Capas de la atmósfera, indicando la altura y la presión barométrica (1000 mbar = 1 atm). Tomado de: “Fundación YPF” (http://www.fundacionypf.org.ar/publicaciones/Tierra/contents/1_histo_tierra/hist_tierra_cont/continentes2.htm)
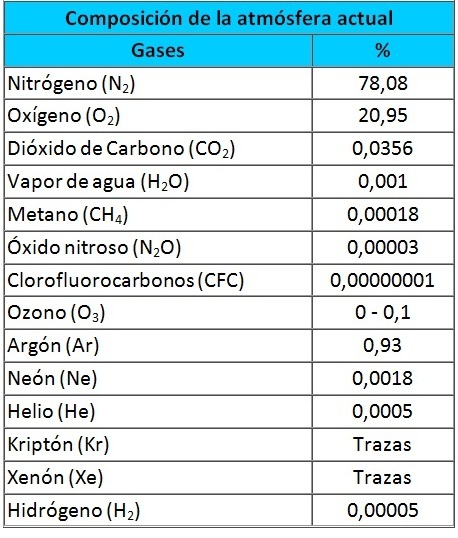
Figura 6.2. Composición del aire al nivel del mar.
CAPA DE OZONO
El ozono (O3) es un gas que forma una capa protectora de la tierra, capaz de filtrar los rayos ultravioletas provenientes del sol. La tierra se halla rodeada en la estratósfera de una capa de ozono, de vital importancia para la vida en el planeta: el ozono actúa como unas gafas de sol, que filtran la luz ultravioleta.
El ozono se forma a partir del oxígeno molecular (O2) mediante la absorción de la luz ultravioleta del sol. Esta reacción es reversible: el ozono puede convertirse nuevamente en oxígeno, mediante la acción de otras sustancias químicas. El problema aparece cuando la aumenta concentración de sustancias que favorecen la transformación de ozono en oxígeno. Entre ellos destacan los CFC (clorofluorocarbonos, compuestos formados por estos tres elementos: C, Cl y F) y los óxidos de nitrógeno, productos de la actividad diaria en la tierra. Debido a esto, existen zonas del planeta que tienen poca protección de ozono: el llamado “agujero” se encuentra ubicado principalmente sobre la Antártida, tal como puedes ver en el siguiente vídeo:
 |
Más sobre la capa de ozono y cómo nos afecta: |
LLUVIA ÁCIDA
El agua pura tiene un pH de 7. Sin embargo, la lluvia natural tiene un pH ligeramente ácido, cercano a 6. La acidez de la lluvia proviene de la presencia en el aire de tres gases principales: dióxido de carbono (CO2), óxido nitrosos (NO) y dióxido de azufre (SO2). Todos estos gases reaccionan con el agua, dando lugar al ácido carbónico (H2CO3), ácido nítrico (HNO3) y ácido sulfúrico (H2SO4), respectivamente.
No podemos evitar que la lluvia sea ácida: el CO2 es un producto de la descomposición orgánica, el NO proviene de las descargas eléctricas y se forma a partir de nitrógeno y oxígeno, mientras que el SO2 es emitido por los volcanes. Sin embargo, un incremente desmesurado en la concentración de estos gases trae consigo que el agua contenga más ácido y, consecuentemente, un pH menor.
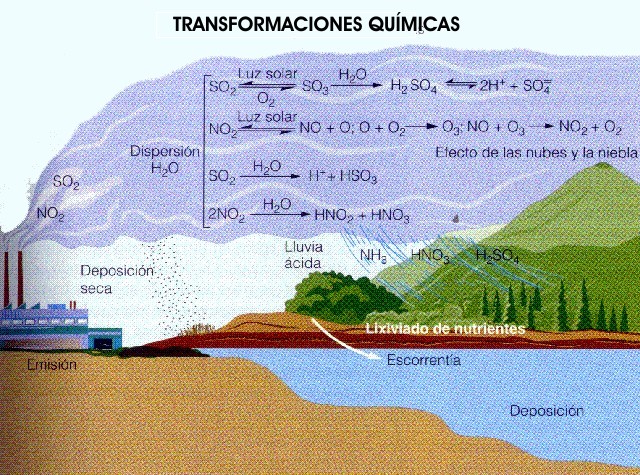
Figura 6.3. Esquema de la formación de la lluvia ácida. Tomado de: “Sagam – Universidad Nacional Autónoma de México” (http://www.sagan-gea.org/hojared/Hoja13.htm)
La lluvia ácida no nos daña directamente a los humanos, pero sí daña nuestro entorno: los bosques se debilitan, los monumentos y ciertas edificaciones se dañan más rápidamente en presencia de ácidos, y la acidez puede resultar perjudicial para muchos peces de agua dulce.

Figura 6.4. Una estatua de mármol afectada por la lluvia ácida. Tomado de: “SIDEAPA de Gómez Palacio” (http://www.sideapa.gob.mx/Cultura_Lluvia_Acida.aspx)
 |
Más sobre la lluvia ácida: |
EFECTO INVERNADERO
La atmósfera, como hemos visto, está compuesta de muchos gases. El 99% de ella es nitrógeno y oxígeno, mientras que sólo un 1% lo forman otros gases, llamados “gases de efecto invernadero”. Algunos de ellos con el dióxido de carbono (CO2), metano (CH4), agua (H2O) y dióxido de nitrógeno (NO2). Estos gases, en pequeñas concentraciones, son vitales para nuestra supervivencia. La energía que llega a la tierra, proveniente del sol, es utilizada sólo en parte, otra fracción de la misma es devuelta al espacio, en forma de energía infrarroja. Los gases del efecto invernadero absorben esta energía, calentando tanto la superficie de la tierra como el aire que nos rodea. Si no existiesen estos gases, el planeta sería aproximadamente 30°C más frío de lo que es ahora.
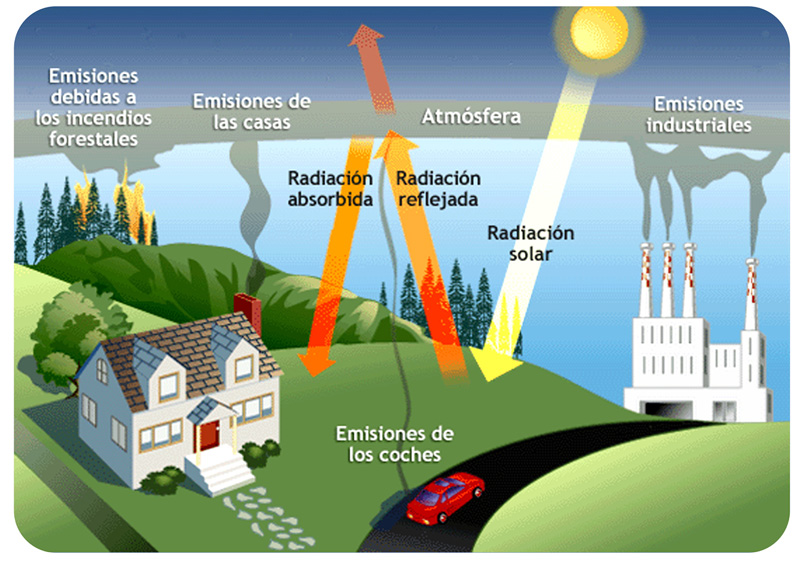
Tomado de (http://es.transferenciadecalorfem.wikia.com/wiki/Ley_de_newton_del_enfriamineto_y_efecto_invernadero)
Lamentablemente, se está produciendo un incremento descontrolado del contenido de dióxido de carbono y agua en la atmósfera, debido a la combustión de combustibles fósiles. Así, en los últimos 60 años, el contenido de CO2 en la atmósfera se ha incrementado en un 20%. Arrhenius, al que ya conocemos del capítulo 2 (cinética química), publicó en 1903 que si se duplica la concentración de CO2 en el aire, la temperatura del planeta subiría unos 5 o 6°C.
Bueno, ¿y qué más da unos grados más de temperatura? Sería bueno tener un verano más largo, ¿no? El problema radica en las consecuencias para el planeta: se produce un aumento de las sequías e inundaciones, deshielo de los casquetes polares y un aumento de las precipitaciones.
 |
Más sobre el efecto invernadero: http://www.portalplanetasedna.com.ar/efecto_invernadero1.htm http://www.bbc.co.uk/spanish/especiales/clima/ghouse_1.shtml |
Leído esto, ahora piensa: ¿Qué podemos hacer para contrarrestar estos problemas ambientales?
CONTAMINACIÓN DEL AGUA
Está claro que necesitamos agua para vivir. Las aguas naturales son soluciones diluidas que contienen muchos compuestos químicos disueltos. El agua potable es aquella que puede ser consumida por el ser humano sin restricción. El agua debe contener ciertos minerales, necesarios para hidratarnos correctamente: no podemos beber agua 100% pura, ya que sin minerales nuestro cuerpo no puede utilizar el agua adecuadamente.
Podemos definir el contaminar el agua como la acción y el efecto de introducir materias o inducir condiciones que impliquen una alteración perjudicial en su calidad. Está claro que el agua del mar no podemos consumirla directamente: necesita ser tratada. Pero eso no implica que esté contaminada, sino que contiene ciertas sustancias que no son saludables. Sin embargo, la contaminación de ríos y mares ocurre a diario. Para muestra, mira las siguientes imágenes:


Tomado de: “Ecologismo-com” (http://www.ecologismo.com/2009/01/12/consecuencias-de-la-contaminacion-del-agua/), “El blog verde” (http://elblogverde.com/contaminacin-del-agua/)
 |
En la siguiente lectura encontrarás información sobre los contaminantes del agua: http://www.tecnun.es/asignaturas/Ecologia/Hipertexto/11CAgu/110ConAg.htm |
