6.3. Concentración y formas de expresarla
La concentración de una solución nos indica la cantidad de SOLUTO presente en una cantidad de SOLUCIÓN.
Si tenemos una solución, el soluto estará presente en una determanida proporción con respecto al solvente. Esa proporción no cambiará a menos que se adicione más soluto o más solvente. En consecuencia, la concentración permanece constante. Es importante notar que la concentración es una propiedad intensiva. Por ejemplo, sabemos que el contenido de alcohol en la cerveza es de 5%. Pero, ¿acaso importa el tamaño de la botella?

No importa el tamaño del envase, la proporción de soluto con respecto al solvente es la misma.
Pero, si a una solución preparada le agregamos más soluto o le agregamos más solvente, la concentración de la solución sí se modifica. En el primer caso se hace más concentrada (aumenta la cantidad de soluto), mientras que en el segundo caso se vuelve más diluída, pues disminuye la cantidad de soluto en relación con el volumen del solvente. Esto lo podemos apreciar en siguiente figura, donde vemos cómo el colorante aparece menos intenso a la izquierda (en una solución diluida), mientras que la intensidad del color aumenta hacia la derecha (solución concentrada). En todos los casos el volumen de solución es el mismo (un vaso), lo que está cambiando es la cantidad de soluto disuelto.

 |
Ten presente lo siguiente
Volumen de una solución = Volumen de soluto + Volumen de solvente
Volumen de solución ≈ Volumen de solvente
Peso de solución = Peso de soluto + Peso de solvente
Densidad de una solución = Peso de solución / Volumen de solución RECUERDA: la densidad sólo sirve para conocer cuánto pesa un determinado volumen de solución. NO NOS DICE la cantidad de soluto disuelto. |
 |
POR TANTO
|
Formas de expresar la concentración de una solución
Ten presente que siempre que tengamos una solución, nos interesará saber CUANTO SOLUTO hay. Por ejemplo, si tenemos una botella de Coca Cola, nos interesa saber cuánta azúcar o cafeína tiene, pero no nos interesa cuánta agua hay. Por tanto, todas las siguientes formas de expresar la concentración están referidas SIEMPRE al soluto.
1. GRAMOS /LITRO
Es la forma más simple: se indica cuántos gramos de soluto hay disueltos por cada litro de solución (g/L):
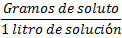
Ejemplo 1: si leemos la información nutricional de la Coca Cola veremos lo siguiente:

Observamos que contiene 11 gramos de hidratos de carbono (o sea, azúcar C12H22O11) por cada 100 mL de solución (equivalente a 0,1 L). Expresemos esto en gramos por litro:
![]()
2. MOLARIDAD
La molaridad (denotada por la letra M mayúscula) nos indica el número de moles de soluto presentes en un litro de solución.
![]()
Ejemplo 2: calculemos para la Coca Cola (del ejemplo 1 anterior) la molaridad del azúcar presente. Sabemos que contiene 11 gramos de C12H22O11 por cada 0,1 L de solución. Por tanto, necesitamos convertir los 11 gramos de soluto a moles de soluto. Para ello, usaremos su masa molar: 342 g/mol.
![]()
Ahora utilizamos la fórmula de molaridad para calcular la concentración molar del azúcar:
![]()
Por tanto, podemos decir que la molaridad del azúcar en la Coca Cola es de 0,32 M, o, lo que es lo mismo, hay 0,32 moles de azúcar por cada litro de solución.
Ejemplo 3: utilicemos el dato de la molaridad de la Coca Cola para averiguar cuánta azúcar tiene una botella de 3 litros de Coca Cola. ¿Cómo procedemos?
Tengamos presente lo siguiente: si conozco el volumen de la solución y la molaridad del soluto que estoy analizando, podré conocer el número de moles de soluto, pues de la ecuación de la molaridad podemos deducir lo siguiente:
![]()
Por tanto, si sabemos que la molaridad del azúcar es 0,32 M, y que tenemos 3 litros de solución, podemos saber cuántas moles de azúcar hay:
![]()
Finalmente, convertimos el número de moles de azúcar a gramos, usando la masa molar (342 g/mol):
![]()
3. PORCENTAJE EN PESO O MASA
El procentaje en peso (o en masa, es lo mismo) indica el peso de soluto con respecto al peso de la solución, expresado en porcentaje:
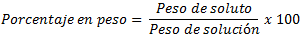
Ten presente que el procentaje en peso SIEMPRE será menor al 100%, pues el peso del soluto siempre debe ser menor al peso de la solución. Asimismo, para conocer el peso de la solución ES NECESARIO saber la densidad de la solución.
Ejemplo 4: para la Coca Cola, expresemos la concentración de azúcar en porcentaje en peso, sabiendo que la densidad de la Coca Cola es 1,05 g/mL.
En este caso, sabemos del ejemplo 1 que hay 110 gramos de azúcar por cada litro de solución. Entonces, sabemos el peso de soluto (110 g), pero no el de la solución. Debemos por tanto, convertir el litro de solución a peso, usando la densidad.
![]()
Y ahora, queda simplemente usar la fórmula de porcentaje en peso:
![]()
Por tanto, podemos decir que de cada 100 gramos de Coca Cola, 10,48 gramos son azúcar.
Ejemplo 5: En la cerveza, el contenido de alcohol etílico (C2H6O) es 5% en peso. Si la densidad de la cerveza es 1,01 g/mL, ¿cuál es la molaridad del alcohol etílico?
Este problema es diferente, pues no tenemos ningún dato de la cantidad de cerveza que hay: sólo conocemos dos propiedades intensivas: la concentración y la densidad. Por tanto, es necesario asumir una cantidad. Dado que me dan el procentaje en peso, asumamos que tenemos 100 gramos de cerveza: de esos 100 gramos de cerveza, 5 gramos son alcohol etílico (eso es lo que nos dice el procentaje en peso).
Convertimos los 5 gramos de C2H6O a moles:
![]()
Ahora necesitamos saber el volumen que ocupan esos 100 gramos, pero expresados en litros. Usamos la densidad:
![]()
Finalmente, usamos la fórmula de molaridad para expresar la concentración de alcohol etílico:
![]()
Por tanto, podemos decir que en un litro de cerveza tenemos 1,1 moles de alcohol etílico.
4. PARTES POR MILLÓN (PPM)
En soluciones diluidas, la concentración del soluto se suele expresar en partes por millón (ppm). La fórmula es idéntica a la del porcentaje en peso, sólo que en vez de multiplicar al cociente por 100, se le multiplica por un millón (106):
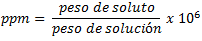
Nuevamente, para conocer el peso de la solución es necesario saber la densidad.
Ejemplo 6: Una lata de Coca Cola de 330 mL (cuya densidad es 1,05 g/mL), contiene 41 mg de cafeína. Expresar la concentración de la cafeína en ppm.
Vean que el contenido de cafeína es muy pequeño (está en miligramos), por ello resulta útil emplear las partes por millón. En efecto, necesitamos tener el peso del soluto y el peso de la solución, TENIENDO CUIDADO que estén en las mismas unidades:
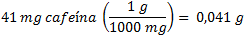
Ahora, para conocer el peso de la solución, usamos la densidad:
![]()
Finalmente, expresamos la concentración en ppm:
![]()
¿Cómo lo interpretamos? Podemos decir que de cada millón de gramos de Coca Cola, 118,3 gramos son cafeína. O para que tengamos valores más tangibles: de cada 1 kilogramo de Coca Cola, 118,3 mg son cafeína.
5. FRACCIÓN MOLAR (X)
La fracción molar la hemos revisado en el tema de gases. La figura que se muestra a continuación explica claramanente lo que significa fracción.
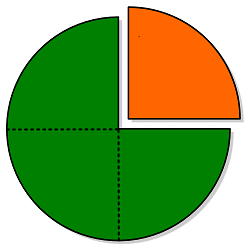
Haciendo una analogía entre la figura mostrada y una solución: el soluto será una parte (denotada en naranja) del todo (verde), éste estará representado por la solución. En el caso de una solución conformada únicamente por un soluto y un solvente, existirán dos fracciones molares (X): la del soluto y la del solvente.

Ejemplo 7: Se tiene un envase que contiene 500 mL de una solución acuosa de NaCl en una concentración de 20g/L. La densidad de la solución es de 1,02 g/mL. ¿Cuál será la fracción molar del NaCl?
La masa de la solución la hallamos con el dato de la densidad, convirtiendo los 500 mL obtenemos 510 g de solución.
- De acuerdo al dato que la solución tiene una concentración de 20g/L y nosotros tenemos medio litro, entonces tenemos 10 gramos de NaCl (el soluto).
- Podemos determinar ahora la masa del solvente: masa solvente = 510g - 10g = 500 g
- Con estos datos, se calcula el número de moles de soluto y número de moles del solvente (H2O).
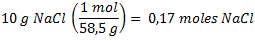
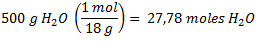
Finalmente, calculamos la fracción molar del NaCl:
![]()
Recuerda que la fracción molar es ADIMENSIONAL (no tiene unidades). Asimismo, la suma de fracciones molares es 1, por tanto, la fracción molar del agua (en el ejemplo) es 0,994.
