6.4. Dilución
Si nos sirven una taza de café y está muy "cargado" (concentración alta de café), lo que hacemos de manera natural es agregarle más agua hasta que que el sabor sea menos intenso o, en otras palabras, que baje la concentración de café. Este procedimiento que realizamos de manera mecánica, es un proceso de dilución. Luego pues, la dilución es el procedimiento que se sigue para preparar una disolución menos concentrada a partir de una más concentrada, y consiste simplemente EN AÑADIR MÁS SOLVENTE.
 |
¿Qué hay que tener en cuenta en una dilución?
|
Imaginemos que tenemos un litro de solución acuosa de lejía (hipoclorito de sodio, NaOCl), cuya molaridad es 0,3 M (solución de la izquierda). Usando la fórmula de molaridad, podemos deducir que hay 0,3 moles de NaOCl. Ahora, como está muy concentrada, añadimos 1 litro más de agua (el solvente), hasta alcanzar el volumen de 2 L (solución de la derecha):
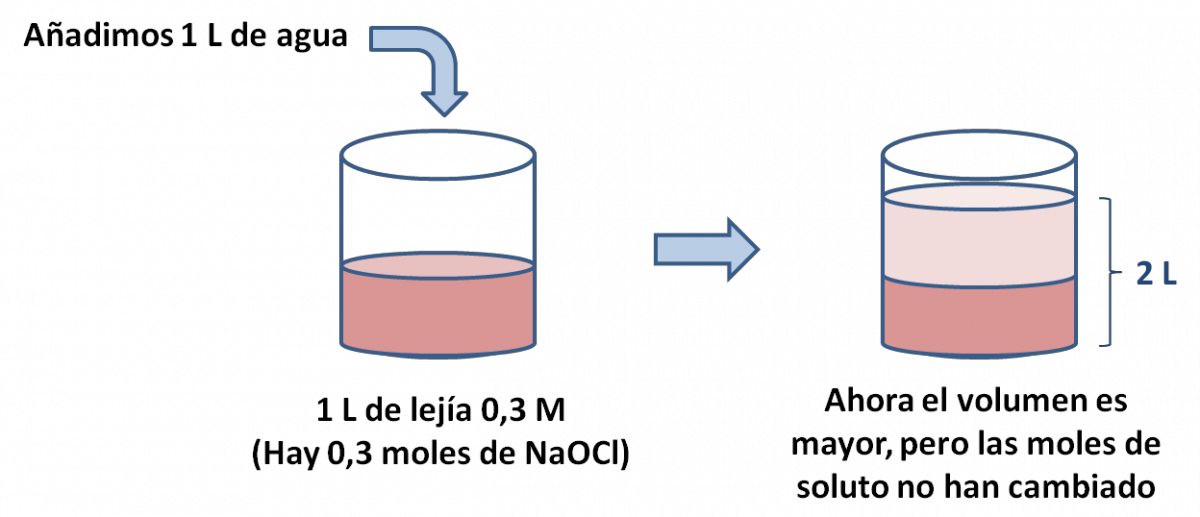
¿Qué ha cambiado? Las moles de NaOCl no cambian, puesto que no hemos añadido soluto. Lo que sí cambia es el volumen de la solución: pasa de 1 L a convertirse en 2 L. Por tanto, la molaridad cambia, y la volvemos a calcular:
![]()
Como vemos, la molaridad disminuye, puesto que estamos diluyendo la solución. SIEMPRE, DESPUÉS DE UNA DILUCIÓN, LA CONCENTRACIÓN DEBE SER MENOR.
 |
Ejercicio 6.4 Se tiene una solución acuosa 1 M de KMn04. ¿Qué volumen de esta solución deberá tomarse para preparar 1 litro de una solución acuosa 0,4 M de KMnO4 ? |
|
La solución de partida es 1 M, esto quiere decir que hay 1 mol de KMnO4 por cada litro de solución, ya que:
Por tanto: Moles de KMnO4 = (1 M) (1 L) = 1 mol La solución diluída debe ser 0,4 M y debemos preparar 1 L, lo que implica que debe contener 0,4 moles. Ahora averiguemos el volumen de la solución de partida que debemos tomar de manera que tengamos los 0,4 moles. Demos establecer que :
Esto significa que debemos tomar 0,4 L (400 mL) de la solución de partida, y agregar agua hasta alcanzar un litro de solución, es decir, debemos añadir 600 mL de agua. |
|
 |
Ejercicio 6.5
|
