7.2. Grupos funcionales
A continuación veremos los principales grupos funcionales, con una descripción breve de sus propiedades y algunos ejemplos.
 |
Más sobre grupos funcionales: http://www.educaplus.org/moleculas3d/alcanos_lin.html |
Hidrocarburos
Son los compuestos más sencillos, formados únicamente por carbono e hidrógeno. Es usual encontrar cadenas largas formadas por enlaces covalentes carbono-carbono, unidos a través de enlaces simples, dobles o triples. Por lo general, tienen bajo punto de ebullición, el cual aumenta conforme aumenta el peso molecular. Asimismo, son apolares. Se usan principalmente como combustibles, ya que liberan calor al ser quemados.
Se clasifican, a su vez, en alcanos, alquenos, alquinos y aromáticos.
Alcanos
En estos hidrocarburos sólo existen enlaces covalentes simples entre los átomos de carbono. Algunos alcanos conocidos son el metano CH4 (componente del gas natural), propano C3H8 (gas usado para uso doméstico) y octano C8H18 (usado como estándar para determinar el octanaje de un combustible).

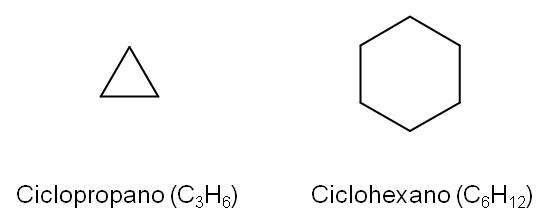
Algunos alcanos pueden encontrarse formando ciclos. En estos casos, se antepone el prefijo “ciclo” al nombre del alcano. Por ejemplo, el ciclopropano tiene tres átomos de carbono dentro de un ciclo, mientras que el ciclohexano tendrá seis átomos de carbono.
 |
Más sobre alcanos: http://www.quimicaorganica.net/alcanos.html |
Alquenos y alquinos
Los alquenos y alquinos son hidrocarburos que presentan insaturaciones, es decir, presentan enlaces ? en su estructura. Los alquenos poseen al menos un enlace doble, mientras que los alquinos tienen un enlace triple como mínimo.
El etileno C2H4 es el alqueno más sencillo. Otro ejemplo de alqueno, aunque con estructura más compleja, es el limoneno, que se encuentra en el limón y que le da el olor característico.

El acetileno C2H2 es el alquino más simple. Se usa en la soldadura, ya que produce, al quemarse, una llama muy caliente (cercana a los 3000°C). Los alquinos son menos abundantes, aunque son más reactivos que los alquenos.

 |
Más sobre alquenos y alquinos: http://www.scribd.com/doc/16264812/ALQUENOS-ALQUINOS |
Aromáticos
El benceno es el principal ejemplo de un compuesto aromático. Para que un hidrocarburo sea aromático, debe presentar un ciclo de seis miembros, y dentro de este ciclo, tres dobles enlaces alternados. El naftaleno C10H8 es también aromático, y es el componente principal de la naftalina. Por otro lado, la vainillina, presente en la vainilla, presenta también un anillo aromático.
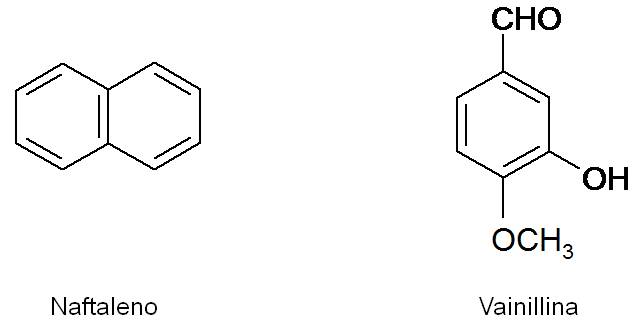
Los compuestos aromáticos muestran una gran estabilidad y son poco reactivos. Asimismo, poseen un olor característico.
 |
Más sobre hidrocarburos aromáticos: http://genesis.uag.mx/edmedia/material/quimicaii/Aromaticos.cfm |
GRUPOS FUNCIONALES QUE CONTIENEN OXÍGENO
Alcoholes
Los alcoholes poseen un enlace C-O-H, es decir, se tiene un oxígeno unido tanto a un carbono como a un hidrógeno por medio de enlaces simples. En forma abreviada, lo representamos así:
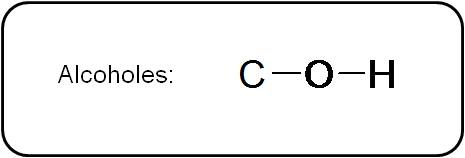
Los alcoholes que no tienen muchos átomos de carbono son solubles en agua y, por lo general, son líquidos a temperatura ambiente (o tienen un punto de ebullición relativamente alto). Esto se debe a que son capaces de formar enlaces de hidrógeno.
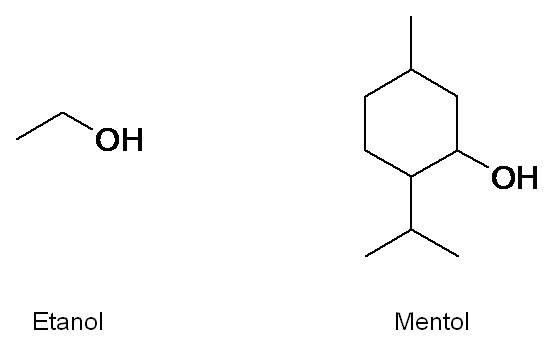
El etanol C2H5OH es uno de los alcoholes más conocidos por nosotros. Lo usamos como desinfectante y es el componente principal de las bebidas alcohólicas. Otro alcohol es el mentol, presente en el aceite de menta, usado en cremas dentales por su olor y sabor característico.
 |
Más sobre alcoholes: http://www.salonhogar.net/quimica/nomenclatura_quimica/Propiedades_alcoholes.htm |
Éteres
Los éteres poseen un oxígeno unido a dos átomos de carbono por medio de enlaces simples. En general:
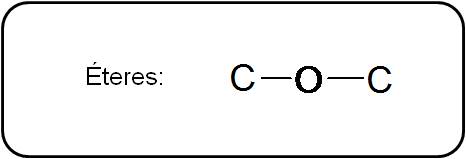
Los éteres tienen punto de ebullición menor que los alcoholes, puesto que no presentan fuerzas intermoleculares de enlace de hidrógeno. Asimismo, debido a esto, son muy poco solubles en agua.
El éter etílico es muy conocido como solvente y fue usado durante muchos años como anestésico, debido a su peculiar olor (que da sueño). El anisol, por otro lado, es el responsable del olor del anís.
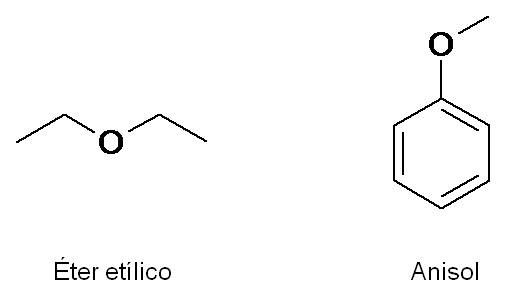
 |
Más sobre éteres: http://www.uam.es/departamentos/ciencias/qorg/docencia_red/qo/l7/nomen.html |
Aldehídos y cetonas
Los aldehídos y cetonas presentan un doble enlace entre un carbono y un oxígeno (denominado grupo carbonilo). La diferencia entre ellos radica en los átomos adyacentes al carbono en mención. En general:

Observa las semejanzas y diferencias entre un aldehído y una cetona: ambos tienen un grupo carbonilo (C=O). El aldehído tiene, unido al carbono del carbonilo, un carbono y un hidrógeno, mientras que una cetona tiene unido sólo átomos de carbono.
Los aldehídos y cetonas con pocos átomos de carbono son solubles en agua. Por lo general son líquidos a temperatura ambiente, aunque tienen bajo punto de ebullición.
El cinamaldehído es un aldehído que se encuentra en la canela y es responsable del olor. La acetona es la cetona más simple, y se usa como disolvente (por ejemplo, para quitar el esmalte de uñas).

 |
Más sobre aldehídos y cetonas: http://www.salonhogar.net/quimica/nomenclatura_quimica/Propiedades_aldehidos_cetonas.htm |
Ácidos carboxílicos
Los ácidos carboxílicos poseen también un grupo carbonilo, pero el carbono está unido, también, a un grupo OH. En general:
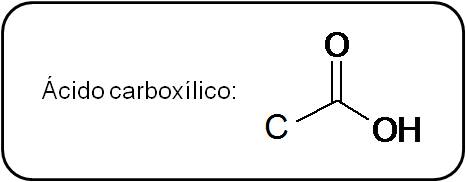
 |
Observaciones
|
Los ácidos carboxílicos de pocos átomos de carbono son solubles en agua, puesto que presentan enlace de hidrógeno como fuerza intermolecular. El ácido acético CH3COOH es un ácido sencillo, componente principal del vinagre. Los ácidos también están presentes en el aceite de casa. Por ejemplo, el ácido linoléico está presente en el aceite de oliva.

 |
Más sobre ácidos carboxílicos: http://www.salonhogar.net/quimica/nomenclatura_quimica/Propiedades_acidos_carboxilicos.htm |
Ésteres
Los ésteres son derivados de los ácidos carboxílicos. La diferencia es que no presentan el grupo –OH, sino que el hidrógeno ha sido reemplazado por un átomo de carbono. En general:

Dado que ya no poseen el grupo –OH, no son capaces de formar enlace de hidrógeno y, por tanto, poseen punto de ebullición menor que el de los ácidos carboxílicos del cual provienen.
Los ésteres suelen tener olores y sabores muy agradables y, por tanto, se utilizan en la industria de alimentos. Por ejemplo, el butanoato de metilo posee olor a piña, mientras que el pentanoato de pentilo tiene aroma a manzana.
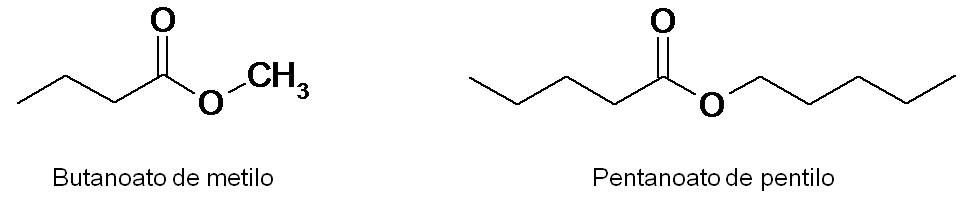
 |
Más sobre ésteres: http://www.uam.es/departamentos/ciencias/qorg/docencia_red/qo/l17/pfis.html |
GRUPOS FUNCIONALES QUE CONTIENEN NITRÓGENO
Aminas y amidas
Las aminas y amidas presentan necesariamente un nitrógeno unido a un carbono. En general:
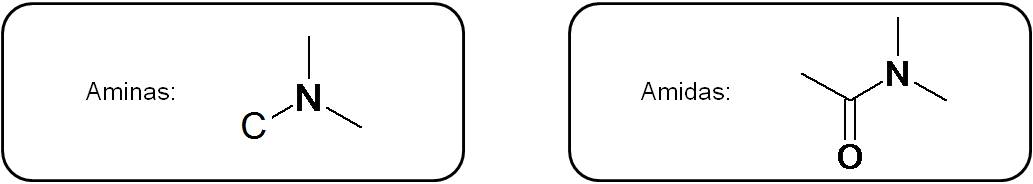
Analiza ambos casos: en el caso de una amina, el nitrógeno está unido a un átomo de carbono, el cual NO ES UN CARBONILO (C=O). Tenemos una amida si el nitrógeno está unido a un carbonilo, es decir, a un carbono unido a oxígeno por un doble enlace.
 |
Observaciones
|
Las aminas tienen mal olor. Putrescina y cadaverina son aminas que se producen cuando se descompone la carne.

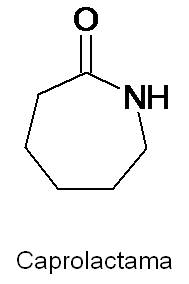
La caprolactama es una amida utilizada en la fabricación del nylon, un polímero muy usado a nivel mundial.
 |
Ejercicio 7.1 Utiliza los siguientes fármacos para identificar grupos funcionales. Encierra en un círculo el grupo funcional y nómbralo.
|


