2.2. Ondas Electromagnéticas - Teorías de Planck y Bohr
Para poder comprender la teoría cuántica de Plank, debemos revisar algunos conceptos sobre ondas. Una onda es una perturbación que se propaga desde el punto en que se produjo hacia el medio que rodea ese punto.
Todas las ondas, menos las ondas electromagnéticas, requieren de un medio físico para propagarse. Éste medio físico se deforma y se recupera vibrando al paso de la onda.
Una onda transporta energía y cantidad de movimiento, pero no transporta materia. Esto quiere decir que las partículas vibran alrededor de la posición de equilibrio pero no viajan con la perturbación.
En función del medio físico que requieren las ondas para su propagación, éstas se clasifican en mecánicas y electromagnéticas. Las ondas mecánicas requieren un medio físico para propagarse. Las electromagnéticas no requieren de un medio físico, se pueden propagar en el vacío.
 |
Ejercicio 2.1 Realicemos dos experimentos: Primer experimento: Si golpeamos con una piedra un tubo metálico, oímos el ruido (sonido) que se emite, éste es una perturbación que se ha propagado en el aire. Segundo experimento: Si golpeamos el mismo tubo metálico con una piedra, pero ahora pegamos nuestra oreja al tubo, oímos el sonido, éste también será una perturbación, pero que se transmite a traves del metal.
|
Propiedades de las ondas
Las ondas se caracterizan por su longitud de onda, frecuencia y amplitud.
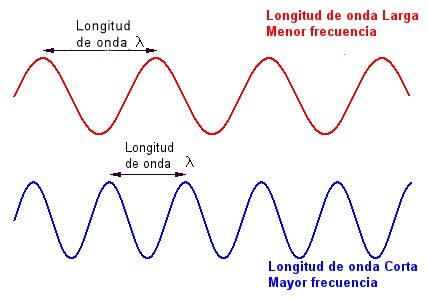
- La longitud de onda (λ, lambda), es la distancia entre dos crestas sucesivas de la onda, se mide en unidades de longitud.
- La frecuencia (ʋ, nu) es el número de ondas que pasan por un punto en un segundo, sus unidades son segundo-1.
- La amplitud es la distancia vertical de la línea media a la cresta de la onda o al valle.
 |
Actividad Interactiva 2.1
Ingresa al siguiente enlace: Trabaja la secuencia interactiva, que se muestra en la página web desplegada. Analiza haciendo uso del ejercicio interactivo, cómo varía la longitud de onda con la variación de la frecuencia. Determina si la variación existente entre la longitud de onda y la frecuencia es directa o inversamente proporcional. |
 |
Deben tener en cuenta que:
c = λ ʋ |
 |
Ejercicio 2.2
NOTA: 1 m = 109 nm 1 Hz = 1 s-1 |
Radiación Electromagnética
Se denomina radiación electromagnética a la emisión y transmisión de energía en forma de ondas electromagnéticas. Las ondas electromagneticas viajan en el vació a la velocidad de la luz (3,0 x 108 m/s).
Gracias a las investigaciones realizadas y a los avances hechos en este campo, podemos hoy en día saber cuál es la naturaleza de la luz: la luz es una perturbación de carácter electromagnético, que se transmite en el vacío.
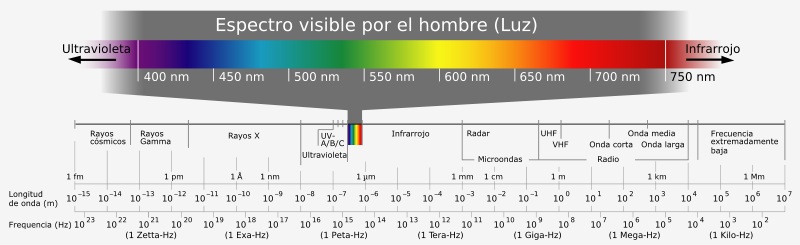
En la siguiente figura pueden observar los difentes tipos de radiación electromagnética, cada una de ellas tiene diferentes valores de longitud de onda y por ende, de frecuencia de radiación.
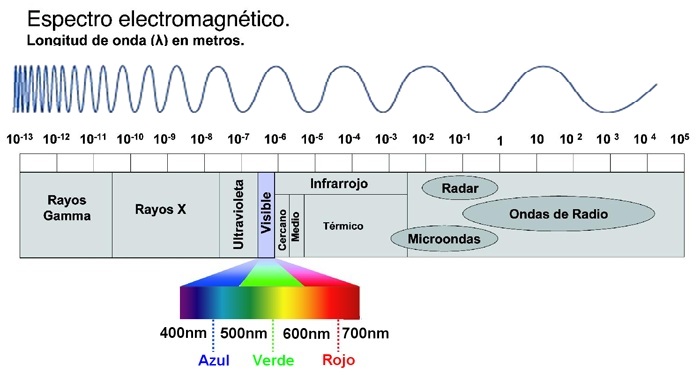
(Tomado de: http://1.bp.blogspot.com/_w1kycNNBkOE/Sw9c8F1HQ7I/AAAAAAAABPw/uJZaCm4HDpI/s1600/ espectro+electromagnetico.png)
El espectro electromagnético se extiende desde la radiación de menor longitud de onda, como los rayos gamma y los rayos X, pasando por la luz ultravioleta, la luz visible y los rayos infrarrojos, hasta las ondas electromagnéticas de mayor longitud de onda, como son las ondas de radio.
 |
Observación
|
Teoría Cuántica de Planck
Si nos imaginamos un trozo de hierro, Fe, que se coloca al fuego durante un tiempo, al retirarlo podemos sentir el calor que está emitiendo y percibir una coloración rojiza.
Si observamos el interior de un foco de luz incandescente de una lámpara, veremos un alambre, éste es de tungsteno (W); si “prendemos” la lámpara, la corriente llega al alambre de tungsteno, le proporciona energía y de inmediato observamos que se vuelve incandescente y emite una luz blanca brillante. El alambre es tungsteno, emite una radiación que cae dentro del espectro electromagnético.
Los sólidos, al calentarse, emiten radiación electromagnética, esta radiación puede abarcar una gran gama de longitudes de onda. Si estas longitudes de onda caen dentro del espectro visible las podremos ver. Observen en el grafico del espectro electromagnético, el rango de longitud de onda del VISIBLE.
 |
No debemos olvidar que hay otras regiones del espectro electromagnético que no podemos ver, pues sus longitudes de onda no caen en la región del visible, sin embargo están presentes, todos sabemos que los rayos UV (ultravioleta) penetran a la capa terrestre y causan estragos en la piel, no los vemos pero sabemos que debemos protegernos de ellos. La razón por la que no vemos esta radiación es porque no cae dentro del visible y nuestros ojos no son capaces de percibirlos. |
Ahora bien, hacia finales del siglo XIX, estas mismas demostraciones llevaron a los científicos a establecer que la cantidad de energía radiante emitida por un objeto a cierta temperatura dependía de la longitud de onda, pero no podían ellos en esa época y con los conceptos que tenían, explicar la razón.
El físico alemán Max Planck, resolvió el problema en 1900, con una suposición que se apartaba de las teorías que por aquella época manejaban los científicos.
Él postuló que la materia (átomos y moléculas) podían emitir o absorber energía en pequeñas unidades discretas (como pequeños paquetes). Planck les dio el nombre de cuanto de energía y lo definió como la mínima cantidad de energía que podía ser emitida o absorbida en forma de radiación electromagnética.
La energía (E) de un solo cuanto de luz estaba dada por:
E= h ʋ
Donde:
• h, es la constante de Planck, cuyo valor es 6,63x10-34 J.s/fotón
• ʋ, es la frecuencia de la radiación.
 |
Ejercicio 2.3 Observen la figura que se da a continuación:
|
|
(Tomado de: http://commons.wikimedia.org/wiki/File:Electromagnetic_spectrum-es.svg Author: Horst Frank) |
|
|
|
Contibución de Bohr a la teoría atómica moderna
Si nos situamos en el año 1913, poco después de los descubrimientos de Planck y de Einstein (cabe señalar que Einstein denominó fotón, a lo que Planck llamó cuanto), los científicos consideraban a los átomos, como unidades donde los electrones giraban a grandes velocidades alrededor del núcleo, en orbitas circulares. Este modelo resultaba atractivo, pues se asemejaba al modelo solar.
Pero los científicos de la época, con estas consideraciones no lograban explicar la razón por la que los espectros de emisión de los átomos al estado gaseoso, no mostraban una distribución continua de longitudes de onda del rojo al violeta; en lugar de ello, los átomos producían líneas brillantes en diferentes partes del espectro visible. Estos espectros de líneas corresponden a las emisiones de luz solo a longitudes de onda específicas.
 |
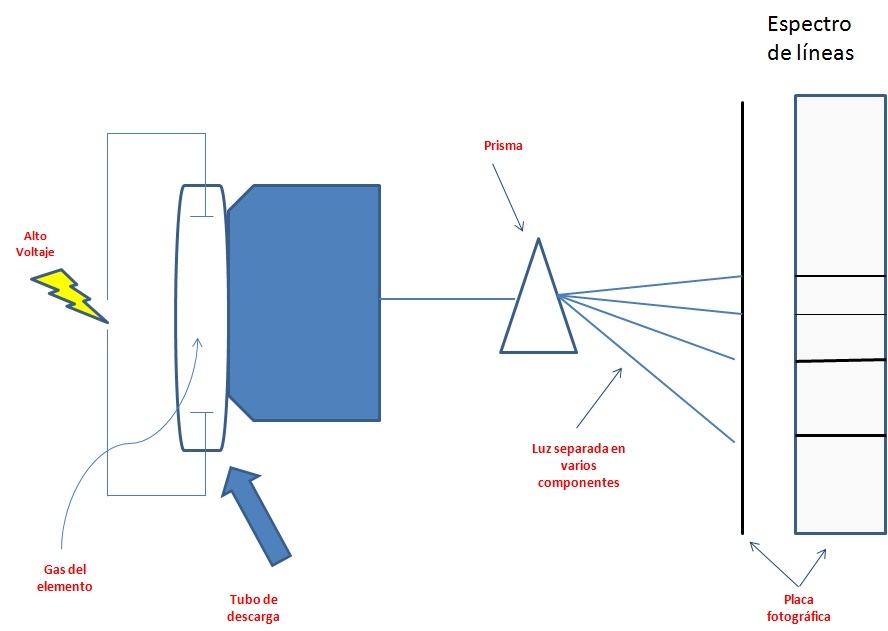
Antes de continuar, un espectro de emisión, explicado de manera muy sencilla, se muestra en la siguiente figura:
En un tubo de descarga, se coloca el elemento al estado gaseoso; el tubo de descarga tienen en su interior un par de electrodos. Se aplica un alto voltaje al tubo de descarga, la corriente eléctrica fluye de un electrodo al otro. La energía es absorbida por el elemento, produciéndose la emisión de luz correspondiente al elemento en estudio; la luz emitida se colecta y pasa por una pequeña rendija, hacia un prisma en donde se descompone. Cada componente de color se enfoca en una posición diferente e imprime su huella en la placa fotográfica que esta a continuación del prisma. De esta manera se obtiene los espectros de emisión de cada elemento. |
 |
Actividad interactiva 2.2 Ingresa al enlace: http://jersey.uoregon.edu/vlab/elements/Elements.html Elige un elemento de la tabla periódica que ahí se muestra y observa el espectro de emisión. Repite con varios elementos para que observes la diferencia que existen entre ellos. Luego analiza el espectro de emisión del hidrógeno y observa cuántas líneas tiene el espectro del átomo de hidrógeno. |
Postulado de Niels Bohr
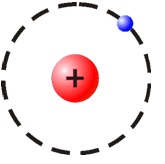 |
Bohr describió el átomo de hidrógeno con un protón en el núcleo y girando a su alrededor un electrón. |
|
Con estas consideraciones, Niels Bohr propuso un modelo atómico, en el que imponía estrictas consideraciones, también llamados los postulados de Bohr:
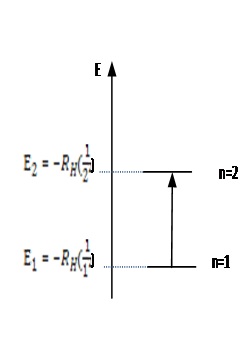
Bohr estableció que para cada órbita permitida, la energía estaría cuantizada conforme a la ecuación: En= - RH (1/n2 ) Donde: En : representa la energía del átomo de hidrógeno en función del nivel en donde se encuentra n : (número entero, que puede tomar los valores n=1, 2, 3, ...) denominado número cuántico, indica la órbita o nivel en donde se encuentra el electrón. RH , la constante de Rydberg, que tiene un valor de 2,18 x 10-18 J/fotón El signo negativo en la ecuación es una convencion arbitraria, que nos indica que existe una energía de atracción del núcleo sobre el electrón. |
|
Cuando el electrón del átomo de hidrógeno se encuentra en el nivel 1, se dice que se encuentra en el estado basal o fundamental; el nivel basal (n=1) es el nivel de mínima energía, el átomo se encuentra estable.
Cuando el electrón del átomo de hidrógeno absorbe energía, puede subir a niveles más altos de energía, pero solo a valores establecidos (n= 1,2, 3,..)
Si hacemos la siguiente analogía:
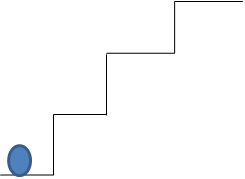
Si la esfera fuera una pelota y se le diera una patada (energía) para que suba la escalera, ésta nunca se podría quedar suspendida entre dos escalones. Si el impulso no es tan fuerte, no alcanza el escalón deseado y cae al escalón más bajo.
Ahora bien:
La pelota sería el electrón, la patada sería la energía proporcionada. Ésta energía es la que el electrón absorbe y puede llegar a ciertos escalones, que son los niveles energéticos.
 |
Ejercicio 2.4 Un electrón del átomo de hidrógeno que se encuentra en el nivel basal (n=1), absorbe energía y sube al nivel (n=2). La energía absorbida en esa transición se calcula ΔE= E2 - E1 En toda transición electrónica de un nivel n inicial a otro nivel n final, la variación de energía ΔE (delta de energía) del atomo será: ΔE= Efinal - Einicial |
|
|
|
|
1. Calcula la energía absorbida en el salto energético del nivel 1 al nivel 2. Señala el signo de la energía ABSORBIDA. 2. Repite el cálculo, pero ahora considera que el electrón se encuentra en el nivel 2 y cae energéticamente al nivel basal. Señala el signo de la energía EMITIDA. 3. Determina la energía del nivel n = 3. Analiza y concluye si los espaciados entre niveles tienen el mismo valor, si aumentan o si se van haciendo cada vez más pequeños. Justifica tu respuesta. 4. Calcula la energía necesaria para llevar el electrón del nivel basal al nivel infinito. El nivel infinito implica que el electrón sale del átomo. |
Relación entre la energía involucrada en un salto energético con la frecuencia o longitud de onda
Si podemos calcular la energía absorbida por un electrón (cuando sube de nivel energético) o la energía emitida, cuando éste baja de nivel energético, podemos también relacionar la variación de energía con la longitud de onda o con la frecuencia involucrada en esa energía.
 |
Para ello recordemos:
|